
【题目】硫酰氯(SO2Cl2) 和亚硫酰氯(SOCl2) 均是重要的化工试剂,遇水发生剧烈反应,常用作脱水剂。
已知:①SO2Cl2 (g)![]() SO2(g)+Cl2(g) △H= +471.7kJ/mol; 平衡常数K1
SO2(g)+Cl2(g) △H= +471.7kJ/mol; 平衡常数K1
②SO2(g) +Cl2(g) +SCl2(g)![]() 2SOCl2(g) △H=-477.3kJ/mol; 平衡常数 K2
2SOCl2(g) △H=-477.3kJ/mol; 平衡常数 K2
(1)反应2SOCl2(g)![]() SO2Cl2(g)+SCl2(g)的平衡常数K=_____(用K1、K2表示) 该反应△H=_____kJ/mol。
SO2Cl2(g)+SCl2(g)的平衡常数K=_____(用K1、K2表示) 该反应△H=_____kJ/mol。
(2)若在绝热、恒容的密闭容器中,投入一定量的SO2Cl2(g)和SCl2(g),发生反应SO2Cl2(g)+SCl2(g)![]() 2SOCl2(g),下列示意图能说明t1时刻反应达到平衡状态的是____(填序号)。
2SOCl2(g),下列示意图能说明t1时刻反应达到平衡状态的是____(填序号)。

(3)为研究不同条件对反应①的影响,在恒温条件下,向2L恒容密闭容器中加入0.2molSO2Cl2,10min后反应①达到平衡。测得10min内v(SO2)= 8.0×10-3mo1·L-1·min-1,则平衡时SO2Cl2的转化率α1=_______。若其它条件保持不变,反应①在恒压条件下进行,平衡时SO2Cl2的转化率α2_____α1(填“>”、“<”或“=”)。若要增大SO2Cl2的转化率,可以采取的措施有______(列举一种)。
(4)锂亚硫酰氯(Li/SOCl2) 电池是一种大容量电池,该电池用锂与石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl4) 溶解在亚硫酰氣(SOCl2)中形成的,其电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S。
①写出电池工作时正极的电极反应式_____________;
②若用此电池做电源,以铂作电极电解200mL 0.2mol.L-1CuSO4溶液,当两极各产生标准状况下896mL的气体时,电池负极消耗锂的质量是______g。
【答案】 ![]() +5.6 bd 80% > 升高温度或增大容器体积或减小压强 3SOCl2+8e-==6Cl-+SO32-+2S 1.12
+5.6 bd 80% > 升高温度或增大容器体积或减小压强 3SOCl2+8e-==6Cl-+SO32-+2S 1.12
【解析】(1)由①+②可得,SO2Cl2(g)+SCl2(g)![]() 2SOCl2(g),则该反应的平衡常数K= K1
2SOCl2(g),则该反应的平衡常数K= K1![]() K2,△H=+471.7kJ/mol+(- 477.3kJ/mol)= -5.6 kJ/mol。因此,反应2SOCl2(g)
K2,△H=+471.7kJ/mol+(- 477.3kJ/mol)= -5.6 kJ/mol。因此,反应2SOCl2(g)![]() SO2Cl2(g)+SCl2的平衡常数K=
SO2Cl2(g)+SCl2的平衡常数K= ![]() ,该反应△H= +5.6 kJ/mol。
,该反应△H= +5.6 kJ/mol。
(2)若在绝热、恒容的密闭容器中,投入一定量的SO2Cl2(g)和SCl2(g),发生反应SO2Cl2(g)+SCl2(g)![]() 2SOCl2(g),该反应前后气体的分子数不变,但是由于该反应是放热反应,故在绝热、恒容条件下,容器内的压强会变大。正反应速率受温度和反应物浓度两个因素影响,t1时刻,图a中不能说明正反应速率和逆反应速率相等,故不能说明达到平衡;图b中t1时刻以后压强不变,说明达到平衡;c图中,各组分的浓度在t1时刻后仍在变化,所以t1时刻没有达到平衡;d图中,t1时刻以后反应物的转化率不再变化了,说明达到平衡。所以能说明t1时刻反应达到平衡状态的是b和d。
2SOCl2(g),该反应前后气体的分子数不变,但是由于该反应是放热反应,故在绝热、恒容条件下,容器内的压强会变大。正反应速率受温度和反应物浓度两个因素影响,t1时刻,图a中不能说明正反应速率和逆反应速率相等,故不能说明达到平衡;图b中t1时刻以后压强不变,说明达到平衡;c图中,各组分的浓度在t1时刻后仍在变化,所以t1时刻没有达到平衡;d图中,t1时刻以后反应物的转化率不再变化了,说明达到平衡。所以能说明t1时刻反应达到平衡状态的是b和d。
(3)反应①为SO2Cl2 (g)![]() SO2(g)+Cl2(g) △H=+471.7kJ/mol,该反应的正反应是一个气体分子数增大的吸热反应。在恒温条件下,向2L恒容密闭容器中加入0.2molSO2Cl2,10min后反应①达到平衡。测得10min内v(SO2)=8.0×10-3mo1.L-1.min-1,则平衡时SO2Cl2的变化量等于n(SO2)=10min
SO2(g)+Cl2(g) △H=+471.7kJ/mol,该反应的正反应是一个气体分子数增大的吸热反应。在恒温条件下,向2L恒容密闭容器中加入0.2molSO2Cl2,10min后反应①达到平衡。测得10min内v(SO2)=8.0×10-3mo1.L-1.min-1,则平衡时SO2Cl2的变化量等于n(SO2)=10min![]() 2L
2L![]() 8.0×10-3mo1.L-1.min-1=0.16mol,所以SO2Cl2的转化率α1=
8.0×10-3mo1.L-1.min-1=0.16mol,所以SO2Cl2的转化率α1=![]() 80%.若其它条件保持不变,反应①在恒压条件下进行,由于该反应正反应是气体分子数增大的方向,所以平衡时容器体积变大,相当于对恒容的平衡状态减压(即增大容器体积),故SO2Cl2的转化率变大,α2 >α1。若要增大SO2Cl2的转化率,可以采取的措施有升高温度或增大容器体积(即减小压强)。
80%.若其它条件保持不变,反应①在恒压条件下进行,由于该反应正反应是气体分子数增大的方向,所以平衡时容器体积变大,相当于对恒容的平衡状态减压(即增大容器体积),故SO2Cl2的转化率变大,α2 >α1。若要增大SO2Cl2的转化率,可以采取的措施有升高温度或增大容器体积(即减小压强)。
(4)由题意及电池总反应方程式8Li+3SOCl2=6LiCl+Li2SO3+2S可知,该电池负极为锂、正极为石墨。负极锂失去电子被氧化,电极反应式为8Li-8e- =8Li+,正极上SOCl2得到电子被还原为S。①电池工作时正极的电极反应式3SOCl2+8e-==6Cl-+SO32-+2S;②若用此电池做电源,以铂作电极电解200mL0.2mol.L-1CuSO4溶液,当两极各产生标准状况下896mL的气体时,因为阳极的电极反应产物只有氧气(阴极产物有铜和氢气),则阳极上产生896mL的氧气,这些氧气的物质的量为0.04mol,所以电路中一定通过了0.16mol e-。由电子转移守恒可知,电池负极消耗锂0.16mol,所以消耗锂的质量是016![]() 7g=1.12g。
7g=1.12g。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】Cl2与CH4在光照条件下,按照体积比1:1反应,则生成的产物为
A.CH3ClB.CH2Cl2C.HClD.CH3Cl、CH2Cl2、CHCl3、CCl4、HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一。
(1)将0.050 mol SO2和0.030 mol O2放入容积为1 L的密闭容器中,反应2SO2(g)+O2(g)![]() 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。
①从平衡角度分析采用过量O2的目的是________________________;
②计算该条件下反应的平衡常数K=________________________。
③已知:K(300℃)>K(350℃),该反应是________热反应。若反应温度升高,SO2的转化率________ (填“增大”、“减小”或“不变”)。
(2)某温度下,SO2的平衡转化率(![]() )与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”,下同)。
)与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”,下同)。
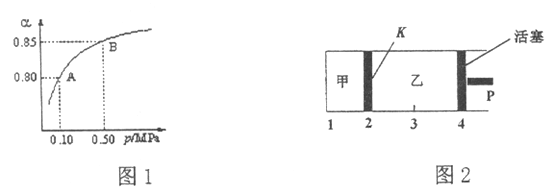
(3)如图2所示,保持温度不变,将2 mol SO2和1 mol O2加入甲容器中,将4 mol SO3加入乙容器中,隔板K不能移动。此时控制活塞P,使乙的容积为甲的2倍。
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲______乙。
②若保持乙中压强不变,向甲、乙容器中通入等质量的氦气,达到新平衡时,SO3的体积分数甲_______乙。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5mol (NH4)2S的质量为__g。
(2)标准状况下,1.7 g NH3与__LH2S气体含有的氢原子数相同。
(3)标准状况下,1.6g某气态氧化物RO2体积为0.56L,该气体的物质的量为__mol,RO2的相对分子质量为__。
(4)与0.2molH2含有相同电子数目的氦气分子的物质的量为_____。
(5)标准状况下, NH3与CH4组成的混合气体的平均密度为0.75g/L,该混合气体的平均摩尔质量为____,该气体对氢气的相对密度为___,NH3的体积分数为____。
(6)同温同压下,等体积的CO和CO2的物质的量之比__,所含氧元素的质量比__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是以有机物A合成聚酯类高分子化合物F的路线:

已知:
回答下列问题:
(1)A生成B的反应类型为_____,C中的官能团名称为________。
(2)D与NaOH水溶液反应的化学方程式为________。
(3)①E生成F的化学方程式为________。
②若F的平均相对分子质量为20000,则其平均聚合度为________。(填字母)
A.54 B.108 C.119 D.133
(4)E在一定条件下还可以合成含有六元环状结构的G。G的结构简式为________。
(5)满足下列条件的C的同分异构体有_____种。(不考虑立体异构)
①含有1个六元碳环且环上相邻4个碳原子上各连有一个取代基
②1mol该物质与斐林试剂反应产生2mol砖红色沉淀
(6)写出用![]() 为原料制各化合物
为原料制各化合物 的合成路线______。(其他试剂任选)
的合成路线______。(其他试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是生物体的一种代谢产物。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。已知草酸晶体(H2C2O42H2O)无色,易溶于水,熔点为101℃,受热脱水、升华,170℃以上分解。试回答下列问题:

(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物,装置C中可观察到有气泡冒出且澄清石灰水变浑浊,由此可知草酸晶体分解的产物中有______。
(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验。
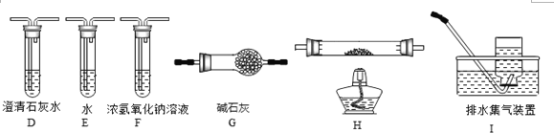
①乙组同学的实验装置中,依次连接的合理顺序为:A→B→( )→D→G→( )→D→I,____________________
②能证明草酸晶体分解产物中有CO的现象是____________________,___________________,第二个D装置中澄清石灰水变浑浊。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了A~R 9种元素在周期表中的位置:(用元素符号回答)
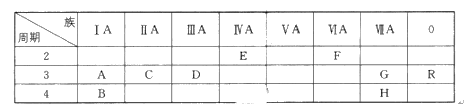
(1)这9种元素其中化学性质最不活泼的是________;
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是_______________;
(3)A、B、C三种元素按原子半径由大到小的顺序排列为________;
(4)F元素氢化物的化学式是________,
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com