
【题目】下列离子方程式书写正确的是( )
A.氧化铝和氢碘酸反应:Al2O3+6HI═2Al3++6I﹣+3H2O
B.用过量氨水吸收二氧化硫:SO2+NH3H2O═HSO3﹣+NH4+
C.洁厕剂和84消毒液混用产生有毒气体:Cl﹣+2H++ClO﹣═Cl2↑+H2O
D.氯碱工业获得氯气:2H++2Cl﹣![]() H2↑+Cl2↑
H2↑+Cl2↑
科目:高中化学 来源: 题型:
【题目】如图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加几滴石蕊溶液。下列实验现象中正确的是( )

A.逸出气体的体积,a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种具有抗痢疾的某种药物的中间体,其合成路线如图:
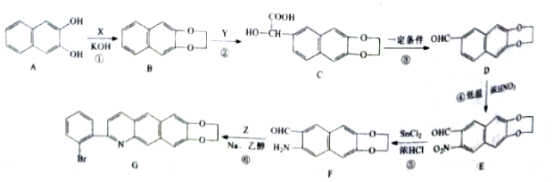
已知:![]() +R3NH2
+R3NH2![]() +H2O
+H2O
(1)X的分子式为C2H4Cl2,写出其化学名称____。
(2)①的反应类型为____。
(3)D中官能团的名称为____。
(4)E的分子式为____。
(5)芳香族化合物Z的分子式为C8H7OBr,写出Z的结构简式____。
(6)同时满足下列条件的D的同分异构体有多种,写出任意一种的结构简式____。
①能与氯化铁发生显色反应
②能与纯碱反应放出二氧化碳气体
③除苯环外无其他环状结构
④核磁共振氢谱为四组峰,峰面积比为1:1:2:6
(7)写出![]() 和
和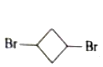 为有机原料制备
为有机原料制备![]() 的流程图。____
的流程图。____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第23号元素钒在地壳中的含量大约为0.009%,在过渡元素中仅次于Fe、Ti、Mn、Zn,排第五位。我国四川攀枝花地区蕴藏着极其丰富的钒钛磁铁矿。
(1)钒在周期表中的位置为__________,电子占据的最高能层的轨道形状为__________。
(2)在地壳中含量最高的五种过渡金属元素Fe、Ti、Mn、Zn、V中,基态原子核外单电子数最多的是__________。
(3)过渡金属可形成许多羰基配合物,即CO作为配体形成的配合物。
①CO的等电子体有N2、CN-、__________(任写一个)等。
②CO作配体时,配位原子是C而不是O,其原因是__________。
(4)过渡金属配合物常满足“18电子规则”,即中心原子的价电子数加上配体提供的电子数之和等于18,如[Fe(CO)5]、[Mn(CO)5]-等都满足这个规则。
①下列钒配合物中,钒原子满足18电子规则的是__________。
A.[V(H2O)6]2+ B.[V(CN)6]4- C.[V(CO)6]- D.[V(O2)4]3-
②化合物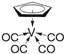 的熔点为138 ℃,其晶体类型为__________;已知该化合物满足18电子规则,其配体“
的熔点为138 ℃,其晶体类型为__________;已知该化合物满足18电子规则,其配体“![]() ”中的大π键可表示为__________。
”中的大π键可表示为__________。
(5)VCl2(熔点1027 ℃)和VBr2(熔点827 ℃)均为六方晶胞,结构如图所示。
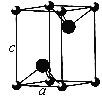
①VCl2和VBr2两者熔点差异的原因是__________。
②设晶体中阴、阳离子半径分别为r-和r+,该晶体的空间利用率为__________(用含a、c、r+和r-的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟硼酸亚锡[Sn(BF4)2]用于粮食制品中防止有机酸的腐蚀。受热或遇水易分解或水解,长期放置在空气中易氧化。以氟硅酸(H2SiF6,二元强酸,易溶于水,其钠盐溶解度较小、硼酸[H3BO3],一元弱酸,酸根为![]() 等为原料制备氟硼酸亚锡,同时得白炭黑(SiO2)和Na2SiF6等副产物的工艺流程如图所示。
等为原料制备氟硼酸亚锡,同时得白炭黑(SiO2)和Na2SiF6等副产物的工艺流程如图所示。

(1)硼酸在水溶液中的电离方程式_____。硼酸水溶液中水的电离程度_____(填“大于”或“小于”或“等于”)同温度下纯水的电离程度。
(2)流程中过程③由锡石制备锡一般工业上加入焦炭,该方法冶炼锡属于哪种冶金方法_____。
A.热分解法 B.电解法 C.热还原法
(3)写出反应④发生的主要反应的化学方程式_____。
(4)原料经反应①过滤后得残留氟硅酸(H2SiF6)杂质的氟硼酸(HBF4)溶液,写出反应①的化学方程式_____。
(5)离心分离前步骤②加NaCl的目的是_____。
(6)氟硼酸亚锡[Sn(BF4)2]的正确保存方法_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Fe3+的电子排布式是_____________________________________________
(2)下列物质中既有离子键又有共价键的是________。
A.MgO B.NaOH C.CaCl2 D.CO2
(3) 关于下列分子的说法不正确的是________。
A.既有σ键又有π键
B.O—H键的极性强于C—H键的极性
C.是极性分子
D.该物质的分子之间不能形成氢键,但它可以与水分子形成氢键
(4)下列说法正确的是________。
A.HOCH2CH(OH)CH2OH与CH3CHClCH2CH3都是手性分子
B.NH3和CH4的空间构型相似
C.BF3与![]() 都是平面型分子
都是平面型分子
D.CO2和H2O都是直线型分子
(5)下列有关性质的比较,正确的是________。
A.第一电离能:O>N
B.水溶性:CH3CH2OH>CH3OCH3
C.沸点:H2S>H2O
D.晶格能:NaCl>MgO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将体积为V1的0.1000 molL﹣1 HCl溶液逐滴加入到体积为V2的0.1000 molL﹣1 Na2SO3溶液中,Na2SO3水溶液中H2SO3、HSO3﹣、SO32﹣在含硫微粒中的物质的量分数随pH的分布如图所示,下列说法正确的是( )
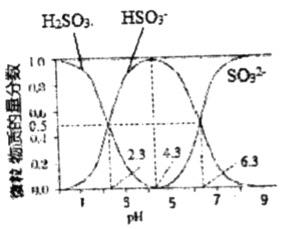
A.在pH=4.3时,溶液中:V1=2V2
B.在pH=2.3时,溶液中:0.1000mol/L>c(HSO3﹣)+c(SO32﹣)+c(H2SO3)
C.在pH=6.3时,溶液中,c(Na+)=c(Cl﹣)
D.在pH=7时,溶液中,c(Na+)=c(HSO3﹣)+2c(SO32﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3.2 g某元素A 的单质与氢气化合生成3.4 g气态氢化物H2A,已知A 的原子核中质子数和中子数相等,则:
(1) A的原子序数为______;
(2) 元素A位于元素周期表中位置:____ _____;
(3) 气态氢化物的化学式是_____,并书写气态氢化物的电子式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知某有机物的分子式为C3H8O,红外光谱和核磁共振氢谱如下图, 氢谱三个峰的面积之比分别为1∶1∶6, 写出其结构简式_____________ (写一种)。


(2)0.2mol某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2mol。试回答:
①烃A的分子式为_____________。
②若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为__________________。
③若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简式为_______________,_____________ ,______________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com