
【题目】3.2 g某元素A 的单质与氢气化合生成3.4 g气态氢化物H2A,已知A 的原子核中质子数和中子数相等,则:
(1) A的原子序数为______;
(2) 元素A位于元素周期表中位置:____ _____;
(3) 气态氢化物的化学式是_____,并书写气态氢化物的电子式_______。
【答案】16 第三周期 第ⅥA族 H2S ![]()
【解析】
(1)根据质量守恒定律,3.2g某元素A的单质与氢气化合生成3.4g气态氢化物H2A,求出参加反应的氢气的质量,根据n(H2)= n(H2A)=n(A),求出n(A),根据M(A)=m/n求出A的摩尔质量,摩尔质量与相对分子质量数值相等,A的原子核中质子数和中子数相等,进而求出A的原子序数,确定该元素;
(2)对于主族元素,周期数=电子层数,族序数=最外层电子数,据此判断该元素在周期表中位置;
(3)H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-S键。
(1)根据质量守恒定律,3.2g某元素A的单质与氢气化合生成3.4g气态氢化物H2A,参加反应的氢气的质量为3.4g-3.2g=0.2g,n(H2)=![]() =0.1mol,则n(H2)=n(A)=0.1mol,M(A)=
=0.1mol,则n(H2)=n(A)=0.1mol,M(A)=![]() =32g/mol,摩尔质量与相对分子质量数值相等,故A的相对分子质量为32,则质量数为32,已知A的原子核中质子数和中子数相等,所以A的原子序数为
=32g/mol,摩尔质量与相对分子质量数值相等,故A的相对分子质量为32,则质量数为32,已知A的原子核中质子数和中子数相等,所以A的原子序数为![]() =16,故A为硫元素;
=16,故A为硫元素;
答案是:16;
(2)A为硫元素,由A原子结构可知,A电子层数为3,最外层电子数为6,故元素A位于元素周期表中第三周期第ⅥA族;
答案是:第三周期第ⅥA族;
(3)S的氢化物为H2S,是共价化合物,硫原子中最外层达8个电子稳定结构,分子中存在两个H-S键,电子式为:![]() ;
;
答案是:H2S;![]() 。
。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】一种新型镁储备电池的储存寿命长,电压平稳,电池的总反应为Mg+Cu2Cl2=2Cu+MgCl2,以该电池为电源在铜片上镀银的实验装置如图所示。

下列说法正确的是
A. 接通电路后,电池的正极质量减小
B. 若反应消耗1mol Mg,则有1mol Cl-通过阴离子交换膜
C. M电极材料为铜片
D. 接通电路后,AgNO3溶液的浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.氧化铝和氢碘酸反应:Al2O3+6HI═2Al3++6I﹣+3H2O
B.用过量氨水吸收二氧化硫:SO2+NH3H2O═HSO3﹣+NH4+
C.洁厕剂和84消毒液混用产生有毒气体:Cl﹣+2H++ClO﹣═Cl2↑+H2O
D.氯碱工业获得氯气:2H++2Cl﹣![]() H2↑+Cl2↑
H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钨晶体晶胞的结构模型如下图所示。实验测得金属钨的密度为19.30![]() 已知钨的相对原子质量为183.8。回答下列问题:
已知钨的相对原子质量为183.8。回答下列问题:
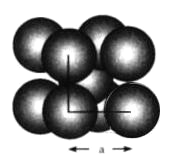
(1)在钨晶体中每个晶胞占有的钨原子数为__________个。
(2)钨晶体晶胞的边长为![]() __________
__________![]() 。
。
(3)钨原子的半径为__________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 最外层都只有2个电子的X、Y原子,化学性质一定相似
B. 在所有的元素中,氟的电负性最大
C. 前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有4种
D. 次氯酸分子的电子式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z、W均为短周期元素,且原子序数依次增大。已知Y原子最外层电子数占核外电子总数的3/4,W-、Z+、X+的离子半径逐渐减小,化合物XW常温下为气体,Z是本周期中除稀有气体元素外,原子半径最大的元素。据此回答下列问题:
(1)W在元素周期表中的位置___________________,实验室制取W单质的离子方程式是____________________________________________________________;
(2)A、B均由上述四种元素中的三种组成的强电解质,A是一种强碱,B是某种家用消毒液的有效成分,则A、B的化学式分别为___________、____________;
(3)C是由Y和Z两种元素组成的一种化合物,其中Y和Z的原子个数比为1∶1,则C的电子式是____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素碳、氧、氮、氟、磷、硒及副族元素镍、铜元素在化学中有很重要的地位,回答下列问题:
(1)在基态14C原子中,核外存在___对自旋相反的电子,基态氮原子的价层电子排布图为____。
(2)将F2通入稀NaOH溶液中可生成OF2,OF2分子构型为__其中氧原子的杂化方式为_______。
(3)CuSO4溶液能用作P4中毒的解毒剂,反应可生成P的最高价含氧酸和铜,该反应的化学方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院大连化学物理研究所的一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,如图所示。

(1)现代石油化工采用Ag作催化剂,可实现乙烯与氧气制备X(分子式C2H4O,不含双键),该反应符合最理想的原子经济,则反应的化学方程式是___(有机物请写结构简式)。
(2)已知相关物质的燃烧热如上表,写出甲烷制备乙烯的热化学方程式___。
(3)在400℃时,向初始体积1L的恒压反应器中充入1molCH4,发生上述反应,测得平衡混合气体中C2H4的体积分数为20.0%。则:
①在该温度下,其平衡常数K=__。
②若向该容器通入高温水蒸气(不参加反应,高于400℃),C2H4的产率将__(选填“增大”“减小”“不变”“无法确定”),理由是___。
③若容器体积固定,不同压强下可得变化如图,则压强的关系是___。

④实际制备C2H4时,通常存在副反应:2CH4(g)→C2H6(g)+H2(g)。反应器和CH4起始量不变,不同温度下C2H6和C2H4的体积分数与温度的关系曲线如图。
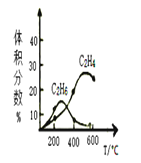
在200℃时,测出乙烷的量比乙烯多的主要原因可能是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M是有机合成的重要中间体,制备M的一种合成路线如下(部分反应条件和试剂略去):

已知:①A的密度是相同条件下H2密度的38倍;其分子的核磁共振氢谱中有3组峰;
② (-NH2容易被氧化);
(-NH2容易被氧化);
③ R-CH2COOH
R-CH2COOH
请回答下列问题:
(1)B的化学名称为______。A中官能团的电子式为______。
(2)C![]() D的反应类型是______,I的结构简式为______。
D的反应类型是______,I的结构简式为______。
(3)F![]() G的化学方程式为______。
G的化学方程式为______。
(4)M不可能发生的反应为______(填选项字母)。
a.加成反应 b.氧化反应 c.取代反应 d.消去反应
(5)请写出任意两种满足下列条件的E的同分异构体有______。
①能与FeCl3溶液发生显色反应 ②能与NaHCO3反应 ③含有-NH2
(6)参照上述合成路线,以![]() 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备![]() 的合成路线:______。
的合成路线:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com