
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去),试回答下列问题:
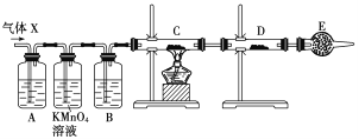
(1)上述反应中生成二氧化硫的化学方程式为______________________________。
(2)乙同学认为还可能产生氢气的理由是__________________________________。
(3)丙同学在安装好装置后,必不可少的一步操作是________________________。
(4)A中加入的试剂可能是_____,作用是__________________________________;B中加入的试剂可能是_____,作用是__________________________________;E中加入的试剂可能是_____,作用是__________________________________。
(5)可以证明气体X中含有氢气的实验现象是:C中:_________________________,D中:_________________________ 。如果去掉装置B,还能否根据D中的现象判断气体X中有氢气?_____ (填“能”或“不能”),原因是______________________________________________________。
【答案】Zn+2H2SO4(浓)==Z nSO4+SO2↑+2H2O 当Zn与浓H2SO4反应时,浓H2SO4浓度逐渐变稀,Zn与稀H2SO4反应可产生H2 检查装置的气密性 品红溶液 检验SO2 浓H2SO4 吸收水蒸气 碱石灰 防止空气中水蒸气进入D中 黑色(CuO)变成红色(Cu) 白色粉末变成蓝色 不能 因为混合气体中含H2O,会干扰H2的检验
【解析】
浓硫酸具有强氧化性,与Zn反应Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O,随着反应的进行,浓硫酸变为稀硫酸,可能发生Zn与稀硫酸反应:Zn+H2SO4=ZnSO4+H2↑,验证H2的存在,通过H2还原氧化铜进行;
(1)生成SO2,发生的化学方程式为Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O;
(2)随着反应进行,浓硫酸的浓度降低,Zn与稀硫酸发生Zn+H2SO4=ZnSO4+H2↑,产生氢气;
(3)需要通入气体,因此实验必不可缺少的一步操作是检验装置的气密性;
(4)根据实验目的,需要检验SO2、H2,检验SO2:利用SO2能使品红溶液褪色,H2不行,因此装置A中盛放的试剂是品红,作用是检验SO2存在;酸性高锰酸钾溶液作用是除去SO2,防止SO2干扰后续实验;检验H2的存在,氢气还原CuO,需要检测H2O,因此装置B中盛放的试剂为浓硫酸,作用是吸收水蒸气,干燥氢气;C装置盛放CuO,D装置盛放无水CuSO4,E装置盛放的试剂可能为碱石灰,防止空气中水蒸气进入D装置,干扰对H2O的检验;
(5)根据(4),证明气体中有氢气,C中现象是黑色变为红色,D中:白色粉末变成蓝色;如果去掉B装置,从高锰酸钾溶液中出来的气体带有水蒸气,对H2的检验产生干扰,因此去掉B装置,不能根据D装置现象判断是否含有H2。


科目:高中化学 来源: 题型:
【题目】海水占地球总储水量的97.2%,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
(1)海水中存在大量的氯化钠,氯化钠中的金属元素位于元素周期表第________族。
(2)目前,国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸气,蒸气经冷却而得高纯度淡水。由此可判断蒸馏法是________________(填“物理变化”或“化学变化”)。
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应式:食盐+H2O―→NaOH+H2↑+Cl2↑(未配平),该反应中食盐的化学式是________________________;利用电解所得气体制36.5%的浓盐酸1 000 t,最少需消耗食盐________ t。
(4)近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法。该方法流程如下:

请写出②④的化学反应方程式:______,________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】暗红色固体X由三种常见的元素组成(式量为412),不溶于水,微热易分解,高温爆炸。
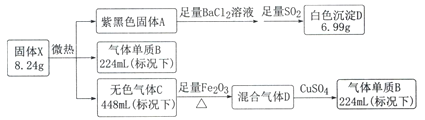
己知:气体B在标准状况下的密度为1.25g.L-1,混合气体通过CuSO4,CuSO4固体变为蓝色。
请回答以下问题:
(1)写出A的电子式____________。
(2)写出生成白色沉淀D的化学方程式________________________。
(3)固体X可由A与过量气体C的浓溶液反应生成,其离子方程式为_________________
(4)有人提出气体C在加热条件下与Fe2O3反应,经研究固体产物中不含+3价的铁元素,请设计实验方案检验固体产物中可能的成分(限用化学方法)________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行实验,装置正确且设计合理的是
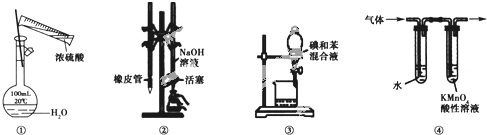
A.图![]() 所示装置进行浓硫酸稀释配制稀硫酸的实验
所示装置进行浓硫酸稀释配制稀硫酸的实验
B.图![]() 所示装置进行用已知浓度为NaOH溶液测定盐酸浓度的实验
所示装置进行用已知浓度为NaOH溶液测定盐酸浓度的实验
C.图![]() 所示装置进行用苯萃取碘水中碘的实验,并把碘的苯溶液从漏斗下口倒出
所示装置进行用苯萃取碘水中碘的实验,并把碘的苯溶液从漏斗下口倒出
D.图![]() 所示装置可检验溴乙烷发生消去反应得到的气体中含有乙烯
所示装置可检验溴乙烷发生消去反应得到的气体中含有乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中一定会造成误差的是
A.将pH试纸用蒸馏水湿润后测某溶液的pH
B.在中和热的测定实验中用![]() 代替NaOH;
代替NaOH;![]() 代替HCl
代替HCl
C.用碱石灰来干燥氨气
D.使用托盘天平称量时将药品放在天平的右盘与砝码放在天平的左盘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在298K、100kPa时,
①C(s,石墨)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1;
②2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1;
③2C2H2(g)+5O2(g)=4CO2(g)+ 2H2O(l) △H3=-2599kJ·mol-1;
则反应2C(s,石墨)+H2(g)=C2H2(g)的反应热△H为( )
A.-237.46kJ·mol-1B.+226.7kJ·mol-1
C.-226.7kJ·mol-1D.+237.46kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示的装置和其他必要的仪器用品,完成下列实验。
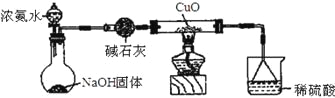
已知2NH3+3CuO![]() N2+3Cu+3H2O,该实验证明氨气具有还原性。
N2+3Cu+3H2O,该实验证明氨气具有还原性。
(1)碱石灰的作用是______________,倒扣漏斗的作用是___________________。
(2)浓氨水与固体NaOH接触,会逸出大量氨气原因是______________________。
(3)硬质玻璃管中可观察到的实验现象是_________________________________。
(4)常温下,若氨水与稀硫酸恰好完全中和,则所得溶液中各离子浓度的大小顺序为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应aA(g)+bB(g)![]() cC(g)+dD(g) ΔH,反应特点与对应的图像的说法中不正确的是( )
cC(g)+dD(g) ΔH,反应特点与对应的图像的说法中不正确的是( )
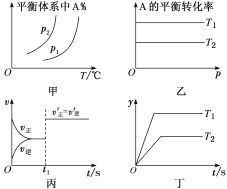
A.图甲中,若p1>p2,则在较低温度下有利于该反应自发进行
B.图乙中,若T2>T1,则ΔH<0且a+b=c+d
C.图丙中,t1时刻改变的条件一定是使用了催化剂
D.图丁中,若ΔH<0,则纵坐标不可能表示的是反应物的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H++OH- △H>0 ,下列叙述正确的是( )
H++OH- △H>0 ,下列叙述正确的是( )
A.向水中加入少量固体硫酸氢钠(忽略溶液温度改变),c(H+)增大,Kw不变
B.向水中加入少量的CH3COONa(忽略溶液温度改变),平衡向右移动,c(H+)增大
C.向水中加入稀氨水,平衡向左移动,c(OH―)降低
D.将水加热,c(H+)增大,c(OH―)降低,Kw增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com