
| n(碱)-n(酸) |
| V(碱)+V(酸) |
| 0.01mol/L×0.1L |
| 0.001mol/L |
| n(碱)-n(酸) |
| V(碱)+V(酸) |
| 0.01mol/L×0.1L-0.01mol/L×VL |
| (0.1+V)L |


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
| c2(NO2) |
| c2(NO)c(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3Cl2+6KOH═5KCl+KClO3+3H2O | ||||
| B、2NO2+2NaOH═NaNO3+NaNO2+H2O | ||||
C、MnO2+4HCl(浓)
| ||||
| D、3CCl4+K2Cr2O7═2CrO2Cl2+3COCl2↑+2KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
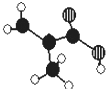 某化工厂生产的某产品只含C、H、O三种元素,其分子模型如图所示:
某化工厂生产的某产品只含C、H、O三种元素,其分子模型如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业上通过电解熔融的氯化钠来制取金属钠 |
| B、钠投入到硫酸铜溶液中有大量的铜析出 |
| C、钠钾合金可在中子反应堆中作热交换剂 |
| D、钠可用于从钛、铌等金属的氯化物中置换出金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、固体氯化钠不导电,所以氯化钠不是电解质 |
| B、氯化氢水溶液能导电,所以氯化氢是电解质 |
| C、CO2溶于水能导电,所以 CO2是电解质 |
| D、铜丝能导电,所以铜是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | E | F | G | H | I | J | |
| 原子半径 (10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
| 最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
| -2 | -3 | -1 | -3 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 配料 | 氯化钠、碘酸钾 |
| 含碘量 | (40~50)mg/kg(以I计) |
| 保质期 | 18个月 |
| 食用方法 | 勿长时间炖炒 |
| 贮藏指南 | 避热、避光、密封、防潮 |
- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol任何气体的体积都约是22.4 L |
| B、18g NH4+含有电子数为1 mol |
| C、NA个H2SO4分子的质量与H3PO4的摩尔质量在数值上相等 |
| D、标准状况下,相同体积的O2、HCl、H2O含有的分子数相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com