
短周期元素A、B、C、D在周期表中的位置如图所示:B、D最外层电子数之和为12。回答下列问题:
(1)与元素B、D处于同一主族的第2-5周期元素单质分别与H2反应生成1 mol气态氢化物对应的热量变化如下,其中能表示该主族第4周期元素的单质生成1 mol气态氢化物所对应的热量变化是_______(选填字母编号)。
a.吸收99.7kJ b.吸收29.7kJ c.放出20.6kJ d.放出241.8 kJ
(2)DB2通过下列工艺流程可制化工业原料H2DB4和清洁能源H2。

①查得:
化学键 | H-H | Br-Br | H-Br |
键能(kJ/mol) | 436 | 194 | 362 |
试写出通常条件下电解槽中发生总反应的热化学方程式: 。
②根据资料:
化学式 | Ag2SO4 | AgBr |
溶解度(g) | 0.796 | 8.4×10-6 |
为检验分离器的分离效果,取分离后的H2DB4溶液于试管,向其中逐滴加入AgNO3溶液至充分反应,若观察到 ,证明分离效果较好。
③在原电池中,负极发生的反应式为 。
④在电解过程中,电解槽阴极附近溶液pH (填“变大”、“变小”或“不变”)。
⑤将该工艺流程用总反应的化学方程式表示为: 。该生产工艺的优点有 (答一点即可)。
(3)溴及其化合物广泛应用于医药、农药、纤维、塑料阻燃剂等,回答下列问题:海水提溴过程中,向浓缩的海水中通入________,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为________________ 。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016届山东省高三12月月考化学试卷(解析版) 题型:实验题
亚硝酸钠是一种工业盐,用途广泛;外观与食盐非常相似,但毒性较强,食品添加亚硝酸钠必须严格控制用量。某化学兴趣小组对食盐与亚硝酸钠进行了如下探究:
㈠鉴别NaCl和NaNO2
(1)测定溶液PH
用PH试纸分别测定0.1mol·L-1两种盐溶液的PH,测得NaNO2溶液呈碱性。NaNO2溶液呈碱性的原因是 ________________________(用离子方程式解释)。NaNO2溶液中c(HNO2)= (用溶液中其它离子的浓度关系式表示)
(2)沉淀法
取2mL0.1 mol·L-1两种盐溶液于试管中,分别滴加几滴稀硝酸银溶液。两只试管均产生白色沉淀。分别滴加几滴稀硝酸并振荡,盛NaNO2溶液的试管中沉淀溶解。
该温度下Ksp(AgNO2)=2×10-8 (mol·L-1)2; Ksp(AgCl)=1.8×10-10(mol·L-1)2
则反应AgNO2(s) +Cl-(aq) AgCl(s)+ NO2-(aq)的化学平衡常数K=
AgCl(s)+ NO2-(aq)的化学平衡常数K=
(3)氧化法
取2mL0.1 mol·L-1两种盐溶液于试管中,分别滴加几滴酸性KMnO4溶液。使酸性KMnO4溶液褪色的是NaNO2溶液。该反应的离子方程式为 。
㈡NaNO2性质探究
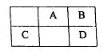
该兴趣小组同学用下图装置探究亚硝酸钠与硫酸反应及气体产物成分。
已知: 气体液化的温度:NO2 21℃ 、 NO –152℃
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A→ → ______→_______→_______;组装好仪器后,接下来进行的操作是________________。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①如何确认A中产生气体是否含有NO _________。(写出实验操作、现象和结论)
②装置E的作用是_______________________。
③若向D中通入过量O2,则装置B中发生反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省温州十校联合体高一上学期期中测试化学试卷(解析版) 题型:选择题
下列关于氯气和氯水的说法中正确的是
A.氯气是一种无色、密度比空气大的有毒气体
B.红热的铁丝在Cl2中剧烈燃烧生成FeCl2
C.新制氯水能杀菌消毒是因为Cl2有毒,能毒杀细菌
D.氯水放置数天后酸性增强
查看答案和解析>>
科目:高中化学 来源:2016届江苏省淮安市高三上学期10月阶段测化学试卷(解析版) 题型:实验题
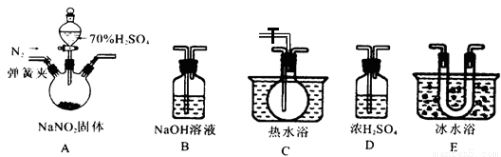
在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。下图所示A-E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
(1)实验空制取、收集干燥的NH3,需选用上述仪器装置中的 , 所用干燥剂的名称为 。
(2)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是 ,写出制纳米级碳酸钙的化学方程式: 。
(3)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级(1nm-100nm之间): 。
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川市高三上学期统练(三)化学试卷(解析版) 题型:选择题
现有常温下的四种溶液:①pH=11的氨水、②0.001mol/L的NaOH溶液、③pH=3的醋酸、④由水电离出的c(H+)=10-11mol/L的盐酸。下列有关叙述正确的是
A.分别加水稀释10倍,四种溶液的pH:①>②>④>③
B.将③、④分别稀释到pH =5,由水电离出氢离子的浓度均减小100倍
C.在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变
D.将①、④两种溶液等体积混合,所得溶液中:c(OH-):c(H+)<1
查看答案和解析>>
科目:高中化学 来源:2016届江西省南昌市高三上学期第四次考试化学试卷(解析版) 题型:实验题
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
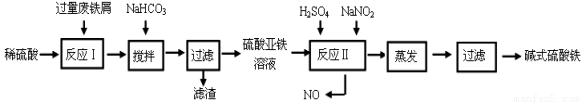
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 | 完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在 范围内,使溶液中的 离子沉淀。
(2)反应Ⅱ中加入NaNO2,反应的离子方程式为 。
(3)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有5.6 L(标准状况),则相当于节约NaNO2的物质的量为 。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为 。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.K3Fe(CN)6溶液
查看答案和解析>>
科目:高中化学 来源:2016届江西省南昌市高三上学期第三次考试化学试卷(解析版) 题型:选择题
在1L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2mol/L和1.5mol/L,现向该溶液中加入39.2g铁粉使其充分反应,下列有关说法正确的是
A.反应后溶液中Fe3+物质的量为0.6mol
B.反应后产生13.44L H2(标准状况)
C.反应后溶液中Fe2+和Fe3+物质的量之和为0.8mol
D.由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三第四次(12月)月考化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.pH=14的溶液中:K+、NH4+、NO3-、HCO3-
B.澄清透明的溶液:Cu2+、Mg2+、SO42-、Cl-
C.0.1mol·L-1Fe(NO3)2溶液中:H+、Ca2+、SCN-、Cl-
D.c(Fe2+)=1.0 mol·L-1溶液:H+、K+、Cl-、MnO4-
查看答案和解析>>
科目:高中化学 来源:2016届陕西西安第一中学高三上学期期中考试化学试卷(解析版) 题型:选择题
利用下图所示装置进行下列实验,不能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A. | 浓盐酸 | KMnO4 | NABr溶液 | 氧化性:KMnO4> Cl2>Br2 | |
B. | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C. | 稀盐酸 | NA2SO3 | BA(NO3)2溶液 | SO2与可溶性钡盐均可生成白色沉淀 | |
D. | 稀硫酸 | NA2CO3 | NA2SiO3溶液 | 酸性:硫酸>碳酸>硅酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com