
亚硝酸钠是一种工业盐,用途广泛;外观与食盐非常相似,但毒性较强,食品添加亚硝酸钠必须严格控制用量。某化学兴趣小组对食盐与亚硝酸钠进行了如下探究:
㈠鉴别NaCl和NaNO2
(1)测定溶液PH
用PH试纸分别测定0.1mol·L-1两种盐溶液的PH,测得NaNO2溶液呈碱性。NaNO2溶液呈碱性的原因是 ________________________(用离子方程式解释)。NaNO2溶液中c(HNO2)= (用溶液中其它离子的浓度关系式表示)
(2)沉淀法
取2mL0.1 mol·L-1两种盐溶液于试管中,分别滴加几滴稀硝酸银溶液。两只试管均产生白色沉淀。分别滴加几滴稀硝酸并振荡,盛NaNO2溶液的试管中沉淀溶解。
该温度下Ksp(AgNO2)=2×10-8 (mol·L-1)2; Ksp(AgCl)=1.8×10-10(mol·L-1)2
则反应AgNO2(s) +Cl-(aq) AgCl(s)+ NO2-(aq)的化学平衡常数K=
AgCl(s)+ NO2-(aq)的化学平衡常数K=
(3)氧化法
取2mL0.1 mol·L-1两种盐溶液于试管中,分别滴加几滴酸性KMnO4溶液。使酸性KMnO4溶液褪色的是NaNO2溶液。该反应的离子方程式为 。
㈡NaNO2性质探究
该兴趣小组同学用下图装置探究亚硝酸钠与硫酸反应及气体产物成分。
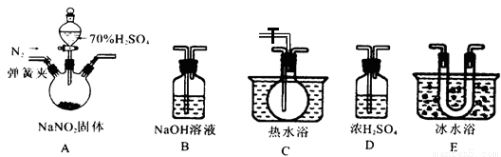
已知: 气体液化的温度:NO2 21℃ 、 NO –152℃
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A→ → ______→_______→_______;组装好仪器后,接下来进行的操作是________________。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①如何确认A中产生气体是否含有NO _________。(写出实验操作、现象和结论)
②装置E的作用是_______________________。
③若向D中通入过量O2,则装置B中发生反应的化学方程式为____________。
 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源:2016届四川省资阳市高三上学期第一次诊断性测试理综化学试卷(解析版) 题型:推断题
有机物A有下图所示转化关系。在A的质谱图中质荷比最大值为88,其分子中C、H、O三种元素的质量比为6∶1∶4,且A不能使Br2的CCl4溶液褪色;1 mol B反应生成了2 mol C。

已知:RCH(OH)—CH(OH)R′ RCHO+R′CHO
RCHO+R′CHO
请回答下列问题:
(1)A的结构简式为_____________。
(2)若①、②、③三步反应的产率分别为90.0%、82.0%、75.0%,则由A合成H的总产率为_____________。
(3)D+E→F的反应类型为___________________。
(4)写出C与银氨溶液反应的离子方程式为______________________。
(5)若H分子中所有碳原子不在一条直线上,则H在一定条件下合成顺丁橡胶的化学方程式为__________。若H分子中所有碳原子均在一条直线上,则G转化为H的化学方程式为________________。
(6)有机物A有很多同分异构体,请写出同时满足下列条件的一种异构体X的结构简式 。
a.X核磁共振氢谱有3个峰,峰面积之比为1∶1∶2
b.1 mol X可在HIO4加热的条件下反应,可形成1 mol 二元醛
c.1 mol X最多能与2 mol Na反应
d.X不与NaHCO3反应,也不与NaOH反应,也不与Br2发生加成反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林实验中学高一上学期期中考试化学试卷(解析版) 题型:选择题
某物质A在一定条件下加热完全分解,产物都是气体,分解方程式为:2A=B+C+2D。测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为
A.7d B.4d C.2.5d D.2d
查看答案和解析>>
科目:高中化学 来源:2016届四川省成都市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列解释事实的化学方程式或离子方程式不正确的是
A.向AgCl悬浊液中加入KI溶液:AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)
B.明矾净水:Al3++3H2O Al(OH)3+3H+
Al(OH)3+3H+
C.90℃时,测得纯水中Kw=3.8×10-13:H2O(l) H+(aq)+OH-(aq) △H<0
H+(aq)+OH-(aq) △H<0
D.用热的纯碱溶液可以清洗油污:CO32-+H2O HCO3-+OH-
HCO3-+OH-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高二上学期期中测试化学试卷(解析版) 题型:填空题
在100℃时,将0.200 mol的四氧化二氮气体充入2L真空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如下表格:
时间 | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) | 0.100 | c1 | 0.050[来 | c3 | a | b |
c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
(1)该反应的化学方程式为_______________________,达到平衡时四氧化二氮的转化率为________%。
(2)20s时四氧化二氮的浓度c1=________mol·L?1,在0~20s时间段内,四氧化二氮的平均反应速率为________mol?L?1?s?1。
(3)若在相同情况下最初向容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的初始浓度为________mol•L?1。
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三12月月考化学试卷(解析版) 题型:选择题
下列有关化学实验叙述正确的是( )
A.容量瓶、滴定管、分液漏斗使用前都必须检查是否漏水
B.用98%的浓硫酸配制100g10%的稀硫酸时,除使用量筒外还需用到容量瓶
C.在钠跟水反应的实验中,切下绿豆粒大小的钠投入水中进行实验,剩余的钠块丢弃到废料桶中
D.若FeCl2溶液中含有I-杂质,可用过量Cl2氧化后进行萃取分液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高一上学期期中测试化学试卷(解析版) 题型:选择题
下列常用实验仪器中,不能直接用于混合物的分离或提纯的是
A.分液漏斗 B.漏斗 C.蒸馏烧瓶 D.容量瓶
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一上学期期中测试化学试卷(解析版) 题型:选择题
报道,科学家已成功合成了少量N4,有关N4的说法正确的是
A.N4和N2是互为同位素
B.N4的摩尔质量是56g
C.相同质量的N4和N2所含原子个数比为2:1
D.每个N4分子含有28个电子
查看答案和解析>>
科目:高中化学 来源:2016届辽宁师范大学附属中学高三上学期期中考试化学试卷(解析版) 题型:填空题
短周期元素A、B、C、D在周期表中的位置如图所示:B、D最外层电子数之和为12。回答下列问题:
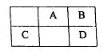
(1)与元素B、D处于同一主族的第2-5周期元素单质分别与H2反应生成1 mol气态氢化物对应的热量变化如下,其中能表示该主族第4周期元素的单质生成1 mol气态氢化物所对应的热量变化是_______(选填字母编号)。
a.吸收99.7kJ b.吸收29.7kJ c.放出20.6kJ d.放出241.8 kJ
(2)DB2通过下列工艺流程可制化工业原料H2DB4和清洁能源H2。

①查得:
化学键 | H-H | Br-Br | H-Br |
键能(kJ/mol) | 436 | 194 | 362 |
试写出通常条件下电解槽中发生总反应的热化学方程式: 。
②根据资料:
化学式 | Ag2SO4 | AgBr |
溶解度(g) | 0.796 | 8.4×10-6 |
为检验分离器的分离效果,取分离后的H2DB4溶液于试管,向其中逐滴加入AgNO3溶液至充分反应,若观察到 ,证明分离效果较好。
③在原电池中,负极发生的反应式为 。
④在电解过程中,电解槽阴极附近溶液pH (填“变大”、“变小”或“不变”)。
⑤将该工艺流程用总反应的化学方程式表示为: 。该生产工艺的优点有 (答一点即可)。
(3)溴及其化合物广泛应用于医药、农药、纤维、塑料阻燃剂等,回答下列问题:海水提溴过程中,向浓缩的海水中通入________,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com