
【题目】下列气体不能用排水法收集的是( )
A.N2B.NO2C.NOD.O2
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如下:(所加试剂均过量,气体全部逸出)
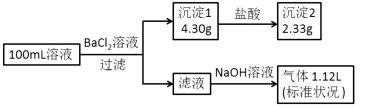
下列说法不正确的是( )
A.原溶液一定存在CO32-和SO42-,一定不存在Fe3+
B.原溶液一定存在Cl-,可能存在Na+
C.原溶液中c(Cl-)≥0.1mol·L-1
D.若原溶液中不存在Na+,则c(Cl-)<0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NH4HCO3的NaCl。某学生设计了如图所示方案提取纯净的NaCl溶液。(已知:NH4HCO3=NH3↑+CO2↑+H2O)

(1)操作②为什么不用硝酸钡溶液,其理由是_______________________________;
(2)进行操作②后,如何判断SO42-已除尽,方法是___________________________;
(3)操作③的目的是____________,其中涉及到的离子方程式是_______________;
(4)往滤液中加入盐酸的离子方程式是__________________________________;
(5)NH4HCO3在水溶液中的电离方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol·L1盐酸、0.55 mol·L1NaOH溶液,实验尚缺少的玻璃用品是 、 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒? (填“能”或“否”),其原因是 。
(3)他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
① | 50 mL 0.55 mol·L1 NaOH溶液 | 50 mL 0.5 mol·L1 HCl溶液 | 20 ℃ | 23.3 ℃ | |
② | 50 mL 0.55 mol·L1 NaOH溶液 | 50 mL 0.5 mol·L1 HCl溶液 | 20 ℃ | 23.5 ℃ | |
已知:Q=cm(t2t1),反应后溶液的比热容c为4.18 kJ·℃1·kg1,各物质的密度均为1 g·cm3。
①计算完成上表。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
(4)若用KOH代替NaOH,对测定结果 (填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果 (填“有”或“无”)影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解下列溶液,一段时间后,加入一定质量的另一种物质(中括号内),溶液能与原来溶液完全一样的是( )
A. CuCl2[CuSO4] B. NaOH[NaOH] C. CuSO4[Cu(OH)2] D. NaCl[HCl]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四个图中,横坐标表示加入物质的物质的量,纵坐标表示生成沉淀的量,从A~D中选择符合各题要求的字母填入表中:

溶液 | 加入的物质 | 图像字母 |
AlCl3溶液 | 通过量的NH3 | ___ |
饱和石灰水 | 通CO2至过量 | ___ |
NaAlO2溶液 | 滴加稀盐酸至过量 | ___ |
含少量NaOH的NaAlO2溶液 | 通过量的CO2 | ___ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为__________、_______。
(2)用甲烷制取氢气的两步反应的能量变化如下图所示:

甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是________________。
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5KJ/mol
②NH2CO2NH4(s)= CO(NH2)2(s) +H2O(g) △H=+116.5KJ/mol
③H2O(l)=H2O(g) △H=+44KJ/mol
写出CO2与NH3合成尿素和液态水的热化学方程式__________________。
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜是重要的铜盐系列化工产品,广泛应用于石油化工、有机合成等行业。CuCl晶体呈白色,微溶于水,不溶于稀盐酸和乙醇,露置于潮湿空气中易水解氧化为绿色的[Cu 2(OH)3C1],见光易分解。某研究小组以CuCl2(含少量Fe2+)粗品为原料制取CuCl,设计的合成路线如下:

己知:①在较高的盐酸浓度下,Fe3+能溶解于甲基异丁基甲酮。
②CuCl在溶液中存在:CuCl(s)+2Cl-(aq)![]() [CuCl3]2-(aq)。
[CuCl3]2-(aq)。
请回答:
(1)下列叙述正确的是__________。
A.CuCl2原料中含有的Fe2+等杂质经氧化、萃取几乎都在有机相中被除去
B.加入萃取剂后,混合物转移至分液漏斗中,塞上玻璃塞,如图用力振摇![]()
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.用浓盐酸洗涤分液后的有机相时,需在分液漏斗中进行
(2)上述合成路线中,SO2通入混合液的实验装置如下图所示:

①装置D的作用是_______________。
②C中反应的离子方程式为_____________。
(3)上述合成路线中,向混合液中加入大量去氧水的目的是________________。
(4)上述合成路线中,一系列操作包括:抽滤、洗涤、干燥。干燥时应注意密封、____________。
(5)现称取l.200g产品,用硫酸酸化的硫酸铁溶解,并稀释成250mL。每次用移液管移取25.00mL溶液于锥形瓶中,用0.01000,mol·L-1KmnO4溶液滴定平均消耗24.00mL。
①用移液管吸取25.00mL溶液后,把溶液转移到锥形瓶中的具体操作为____________。
②产品中CuCl的纯度为__________(本实验条件下,Cl-难于被MnO4-氧化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中加入A和B,各物质的物质的量浓度随着反应的进行,如右图所示。下列说法不正确的是

A. 该反应的化学方程式为5A+4B![]() 4C
4C
B. 2min前,正反应速率逐渐减小,逆反应速率逐渐增大
C. 用B的浓度变化表示2min内的速率为2mol/(L·min)
D. 2min时,该反应达到平衡,此时A、B、C的浓度比为5:4:4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com