
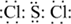 ��
��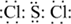 ��
��| 0.075mol��1 |
| 2 |
| 0.0625mol��2 |
| 1 |


 ��ѧ����ͬ����ϰϵ�д�
��ѧ����ͬ����ϰϵ�д� ��ǰ�κ�ͬ����ϰϵ�д�
��ǰ�κ�ͬ����ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ü�ȩ���ݺ��� |
| B��������ư�ľ�� |
| C����С�մ������ͷ� |
| D���ù�ҵ�ƾ����ư� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������Se���������I2�ǻ�ԭ���� |
| B��SeO2��H2SO4��Ũ����I2����������ǿ������˳����I2��SeO2��H2SO4��Ũ�� |
| C�����³�ѹ�£�Se�ǹ��壬������������Ӧ��ˮ������H2SeO4 |
| D����Ӧ����ÿ��0.6mol I2���ɣ�ת�Ƶ�����ĿΪ2.4NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| �� | �� | Na2CO3 | ���ʯ | ʯī | |
| �۵㣨�棩 | 63.65 | 97.8 | 851 | 3550 | 3850 |
| �е㣨�棩 | 774 | 882.9 | 1850���ֽ����CO2�� | ---- | 4250 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ij��ɫ����Һ�����ܺ����������ӣ�Mg2+��Al3+��Fe3+��Ba2+��H+��NH4+��SO42-��HCO3-��Cl-��ȡ����Һ��������ʵ�飺
ij��ɫ����Һ�����ܺ����������ӣ�Mg2+��Al3+��Fe3+��Ba2+��H+��NH4+��SO42-��HCO3-��Cl-��ȡ����Һ��������ʵ�飺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com