
| A、①中Se是氧化产物,I2是还原产物 |
| B、SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是I2>SeO2>H2SO4(浓) |
| C、常温常压下,Se是固体,其最高价氧化物对应的水化物是H2SeO4 |
| D、反应①中每有0.6mol I2生成,转移电子数目为2.4NA |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、鸡蛋白溶液中,加入浓的硫酸铵溶液有沉淀析出,加入水后沉淀不溶解 |
| B、蛋白质水解的最后产物是氨基酸 |
| C、蛋白质和浓硝酸作用时呈黄色 |
| D、人工合成的具有生命活力的蛋白质-结晶牛胰岛素是我国科学家1965年首次合成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是氢氧燃料电池构造示意图,电解质用的是30%的KOH溶液.关于该电池的说法不正确的是( )
如图是氢氧燃料电池构造示意图,电解质用的是30%的KOH溶液.关于该电池的说法不正确的是( )| A、a极是负极 |
| B、电子由b通过灯泡流向a |
| C、氢氧燃料电池是环保电池 |
| D、正极的电极反应是:O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
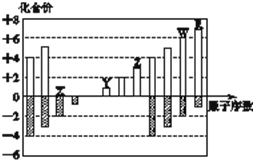 如图所示是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
如图所示是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )| A、原子半径:Z>Y>X |
| B、气态氢化物的稳定性:R>W |
| C、WX3和水反应形成的化合物是离子化合物 |
| D、Y和Z两者最高价氧化物对应的水化物不能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增加A的量,平衡向正反应方向移动 |
| B、升高温度,平衡向逆反应方向移动,v(正)增大 |
| C、压强增大一倍,平衡不移动,v(正)、v(逆)增大 |
| D、加入催化剂,B的转化率提高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com