
【题目】已知H2A为二元酸,其酸式盐NaHA的水溶液呈碱性,则下列有关结论错误的是( )
A.H2A为二元弱酸B.NaHA水溶液中:c(Na+)>c(HA-)>c(H2A)>c(A2-)
C.物质的量浓度相同时,碱性:Na2A>NaHAD.H2A在水溶液中电离方程式为:H2A=2H++A2-
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是

A. 图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B. 图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C. 图丙是室温下用0.1000 mol·L1NaOH溶液滴定20.00 mL 0.1000 mol·L1某一元酸HX的滴定曲线,说明HX是一元强酸
D. 图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42)的关系曲线,说明溶液中c(SO42 )越大c(Ba2+ )越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在一定条件下2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-QkJ·mol-1。向一密闭容器中加入2 mol SO2和1 mol O2,达平衡时SO2的转化率为90%,放出的热量为Q1;向另一相同容器中加入2 mol SO3,在相同条件下,达平衡时吸收的热量为Q2,则下列关系中正确的是( )
2SO3(g) ΔH=-QkJ·mol-1。向一密闭容器中加入2 mol SO2和1 mol O2,达平衡时SO2的转化率为90%,放出的热量为Q1;向另一相同容器中加入2 mol SO3,在相同条件下,达平衡时吸收的热量为Q2,则下列关系中正确的是( )
A.Q>Q1>Q2B.Q1>Q2>QC.Q1>Q>Q2D.Q1=Q2>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把煤作为燃料可通过下列两种途径获得热量:
途径Ⅰ:C(s)+O2(g)═CO2(g) △H1<0 ①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)═CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2(g)═2CO2(g) △H3<0 ③
2H2(g)+O2(g)═2H2O(g) △H4<0 ④
请回答下列问题:
(1)途径Ⅰ放出的热量理论上____(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量。
(2)途径Ⅱ在制水煤气的反应里,反应物所具有的总能量____生成物所具有的总能量(填“大于”、“等于”或“小于”),因此在反应时,反应物就需要___能量才能转化为生成物。
(3)途径I中通常将煤块粉碎、经脱硫处理、在适当过量的空气中燃烧,这样处理的目的是______
①使煤充分燃烧,提高能量的转化率 ②减少SO2的产生,避免造成“酸雨”
③减少有毒的CO产生,避免污染空气 ④减少CO2的产生,避免“温室效应”
(4)△H1、△H2、△H3、△H4的数学关系式是____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤烟气的脱硫脱硝是目前研究的热点。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJmol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJmol-1
③H2O(g)=H2O(l) △H=-44 kJmol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l) 的热化学方程式_________。
(2)某科研小组研究臭氧氧化--碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、活化能数据如下:
反应Ⅰ:NO(g)+ O3(g) NO2(g)+O2(g) △H1= -200.9 kJmol-1Ea1= 3.2 kJmol-1
反应Ⅱ:SO2(g)+ O3(g) SO3(g)+O2(g)△H2= -241.6 kJmol-1 Ea2= 58 kJmol-1
已知该体系中臭氧发生分解反应:2O3(g) 3O2(g)。请回答:
其它条件不变,每次向容积为2L的反应器中充入含1.0 mol NO、1.0 mol SO2的模拟烟气和2.0 mol O3,改变温度,反应相同时间t后体系中NO和SO2的转化率如图所示:
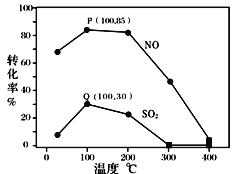
①由图可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因_______。
②下列说法正确的是 ____________ 。
A.P点一定为平衡状态点
B.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
C.其它条件不变,若缩小反应器的容积可提高NO和SO2的转化率
③假设100℃时P(NO转化率为85%)、Q(SO2转化率为30%)均为平衡点,此时反应时间为10分钟,发生分解反应的臭氧占充入臭氧总量的10%,则体系中剩余O3的物质的量是_______mol;NO的平均反应速率为_______________;反应Ⅱ在此时的平衡常数为_______________ 。
(3)用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入如图装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能:
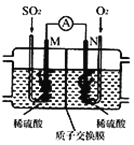
①M极发生的电极反应式为 ____________。
②当外电路通过0.2 mol电子时,质子交换膜左侧的溶液质量_____(填“增大”或“减小”)_______克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是

A.31d和33d属于同种核素
B.气态氢化物的稳定性:a>d>e
C.工业上常用电解法制备单质b
D.a和b形成的化合物不可能含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,进行下列反应:2A(g)+B(g)+C(g)![]() D(g)+E(g) ΔH>0,达到平衡后,下列说法中正确的是( )
D(g)+E(g) ΔH>0,达到平衡后,下列说法中正确的是( )
A.若恒温定容情况下,充入一些稀有气体,压强增大,平衡向右移动
B.若恒温定压条件下,加入C,则C的转化率将增大
C.若定容升温,在新平衡体系中A的质量分数将减小
D.温度、压强和容积都相同时,在另一密闭容器中加入2molA、1molB、1molC,平衡时两个容器中D和E的浓度分别相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达到平衡,平衡常数K=c(CO)·c(H2O)/ c(CO2)·c(H2)。恒容时,温度升高,H2浓度减小。下列说法正确的是
A. 该反应的焓变为负值 B. 恒温恒容下,增大压强,H2浓度一定减小
C. 升高温度,逆反应速率减小 D. 该反应的化学方程式为CO2+H2 ![]() CO+H2O
CO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将![]() 完全溶于水得到VmL氨水,溶液的密度为
完全溶于水得到VmL氨水,溶液的密度为![]() ,溶质的质量分数为
,溶质的质量分数为![]() ,溶质的物质的量浓度为
,溶质的物质的量浓度为![]() 下列叙述中正确的有( )
下列叙述中正确的有( )
![]() 若上述溶液中再加入水至所得溶液的质量分数等于
若上述溶液中再加入水至所得溶液的质量分数等于![]() 时,溶质的物质的量浓度小于
时,溶质的物质的量浓度小于![]() ;
;
![]() ;
;
![]() ;
;
![]() 上述溶液中再加入
上述溶液中再加入![]() 同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为
同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为![]() ;
;
A. ![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com