
【题目】下列各对物质中,互为同系物的是( )
A.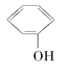 与
与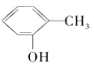
B.HCOOCH3与CH3CH2COOH
C.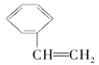 与CH3-CH=CH2
与CH3-CH=CH2
D.C6H5OH与C6H5CH2OH
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10 L的固定容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,反应过程如图,下列说法正确的是( )
2NH3(g) ΔH<0,反应过程如图,下列说法正确的是( )

A.t1 min时正、逆反应速率相等
B.X曲线表示NH3的物质的量随时间变化的关系
C.0~8min,H2的平均反应速率v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
D.10min,改变条件为升温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为: WO3(s) + 3H2(g)![]() W (s) + 3H2O (g),请回答下列问题:
W (s) + 3H2O (g),请回答下列问题:
(1)在一定温度下进行上述反应,若反应容器的容积为0.5 L,2min后达到平衡,测得固体的质量减少了4.80 g,则H2的平均反应速率______;该反应的平衡常数表达式K=_____。
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为__________;随温度的升高,H2与水蒸气的体积比减小,则该反应为______(填“吸热”或“放热”) 反应。
(3)一定温度下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是________。
A.混合气体的总压强保持不变 B.v正(H20)= v正(H2)
C.混合气体的密度保持不变 D.混合气体的平均式量保持不变
(4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2(g)![]() WI4(g)。下列说法正确的有__________。
WI4(g)。下列说法正确的有__________。
A.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.灯管内的I2可循环使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.N2O与CO2、CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化
C.H2CO3与H3PO4的C、P杂化相同
D.由第ⅠA族和第ⅥA族元素形成的原子个数比为1∶1、电子总数为38的化合物,是含有共价键的离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是现代工业的重要原料,将氯化氢转化为氯气的技术成为科学研究的热车点,回答下列问题:
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。可按下列催化过程进行:
Ⅰ.CuCl2(s)=CuCl(s)+![]() Cl2(g) ΔH1=+83kJ·mol-1
Cl2(g) ΔH1=+83kJ·mol-1
Ⅱ.CuCl(s)+![]() O2(g)=CuO(s)+
O2(g)=CuO(s)+![]() Cl2(g) ΔH2=-20kJ·mol-1
Cl2(g) ΔH2=-20kJ·mol-1
Ⅲ.4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH3
反应Ⅰ能自发进行的条件是___。利用ΔH1和ΔH2计算ΔH3时,还需要利用反应___的ΔH。
(2)如图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:

可知反应平衡常数K(400℃)__K(500℃)(填“大于”或“小于”)。设容器内初始压强为p0,根据进料浓度比c(HCl):c(O2)=4:1的数据,计算400℃时容器内的平衡压强=___(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl):c(O2)过低、过高的不利影响分别是___。
(3)已知:氯气与NaOH溶液反应可生成NaClO3。有研究表明,生成NaClO3的反应分两步进行:
Ⅰ.2ClO-=ClO2-+Cl-
Ⅱ.ClO2-+ClO-=ClO3-+Cl-
常温下,反应Ⅱ能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:___。
(4)电解NaClO3水溶液可制备NaClO4,写出阳极反应式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计及其对应的离子方程式均正确的是
A.过量的铁粉溶于稀硝酸:Fe+4H++NO3-=Fe3++NO↑+2H2O
B.澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O
C.用惰性电极电解MgCl2溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D.室温下,氯化铵溶液pH<7的原因:NH4++H2O=NH3·H2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s,白)+2HCl(aq)=SnCl2(aq)+H2(g) △H1
②Sn(s,灰)+2HCl(aq)=SnCl2(aq)+H2(g) △H2
③Sn(s,灰)![]() Sn(s,白) △H3=+2.1kJmol-1
Sn(s,白) △H3=+2.1kJmol-1
下列说法正确的是( )
A.△H1>△H2
B.锡在常温下以灰锡状态存在
C.灰锡转为白锡的反应是放热反应
D.锡制器皿长期处在低于13.2℃的环境中,会自行毁坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢叠氮酸(HN3)和莫尔盐[(NH4)2SO4·FeSO4·6H2O]是两种常用原料。
(1)氢叠氮酸易溶于水,25℃时,该酸的电离常数为Ka=10×10-5。
①氢叠氮酸在水溶液中的电离方程式为_______
②0.2mol/L的HN3溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃,此时,溶液呈酸性,则混合溶液中各离子和HN3分子浓度由大到小的顺序为_______。
(2)在FeSO4溶液中,加入(NH4)2SO4固体可制备莫尔盐晶体[(NH4)2Fe(SO4)2·6H2O],为了测定产品纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下:(已知莫尔盐的分子量为392)
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 25.52 | 25.02 | 24.98 |
①配制莫尔盐溶液,所使用的玻璃仪器除了烧杯和玻璃棒外还有_______
②滴定终点的现象是_______,通过实验数据,计算该产品的纯度为_______(用含字母a、c的式子表示)。
③上表第一次实验中记录数据明显大于后两次,其原因可能是_______。
A 第一次滴定时,锥形瓶用待装液润洗
B 该酸性高锰酸钾标准液保存时间过长,部分变质
C 滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应为:
⑴4FeO·Cr2O3+8Na2CO3+7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
⑵2Na2CrO4+H2SO4![]() Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
下列说法中正确的是
A.反应⑴和⑵均为氧化还原反应
B.反应⑴的氧化剂是O2,还原剂是FeO·Cr2O3
C.高温下,O2的氧化性大于Fe2O3小于Na2CrO4
D.生成1mol的Na2Cr2O7时共转移7mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com