
����Ŀ�����е�����У���NaCl�� ��NaOH����NH3H2O�� ��CH3COOH�� ��BaSO4��H2O
��1����������ʣ�����ţ���
��2��pH��ͬ��NaOH��Һ�백ˮ����ˮϡ����ͬ�ı�����pH�����
��3����pH��Ϊ2�����ᡢ����ʹ���������Һ������ʹ����Ũ�ȴ�С˳��Ϊ��
C��HCl����CH3COOH�����������=�������ֱ������������кͺ������ʵ�����NaOH����Һ�������������ֱ�Ϊa��b��c�������ǵĹ�ϵ�� ��
��4��25��ʱ����0.01mol/L�Ĵ�����Һ��CH3COOH�ĵ��뷽��ʽ����ĵ���ƽ�ⳣ������ʽ �� ��ƽ��ʱ��Һ�������ӵ�Ũ����25�棬����ĵ��볣��Ϊ1.6��10��5������ĵ���̶Ⱥ�С���ɽ�����Ϊ�����Ũ�Ȳ��䣩��
���𰸡�
��1���ۢܢ�
��2����ˮ
��3������a=b��c
��4��CH3COOH ![]() CH3COO��+H+��K=
CH3COO��+H+��K= ![]() ��4��10��4mol/L
��4��10��4mol/L
���������⣺��1����NH3H2O�� ��CH3COOH����H2O��ˮ��Һ��ֻ�ܲ��ֵ��룬����������ʣ���NaCl�� ��NaOH�� ��BaSO4 �� ��ˮ��Һ��������״̬���ܹ���ȫ���룬����ǿ����ʣ�
���Դ��ǣ��ۢܢޣ� ��2��һˮ�ϰ�Ϊ������ʣ���Һ�в��ֵ�������������ӣ�ϡ�ͺ�һˮ�ϰ��ĵ���̶�������Һ�����������ӵ����ʵ�����������ϡ����ͬ�ı�����ˮ��pH��������������Һ�ģ�
���Դ��ǣ���ˮ����3�������������ǿ�ᣬ���������ᣬ��c��H+��=c��HCl��=0.01mol/L��c��H+��=2c��H2SO4��=0.02mol/L��c��H+��=0.01mol/L��c��CH3COOH��������
�Ȼ�������ʵ���Ũ��С�ڴ�������ʵ���Ũ�ȣ��к�һ����NaOH��Һ��������ʱ�����Ũ����ȣ������һԪ�ᣬ������������ȣ�����Ƕ�Ԫ�ᣬ��������һԪ���һ�룬����������������С��ϵ��a=b��c��
���Դ��ǣ�����a=b��c����4������Ϊ������ʣ����ֵ��룬���뷽��ʽ��CH3COOH ![]() CH3COO��+H+������ƽ�ⳣ������ʽK=
CH3COO��+H+������ƽ�ⳣ������ʽK= ![]() ��
��
�����������ʵ���Ũ��Ϊxmol/L�������ݵ���ƽ�ⳣ������ʽK= ![]() ����x��x=K[CH3COOH]����x2=1.6��10��5��0.01mol/L�����x=4��10��4mol/L��
����x��x=K[CH3COOH]����x2=1.6��10��5��0.01mol/L�����x=4��10��4mol/L��
���Դ��ǣ�CH3COOH ![]() CH3COO��+H+��K=
CH3COO��+H+��K= ![]() ��4��10��4mol/L��
��4��10��4mol/L��
�����㾫��������ǿ����ʺ�������ʵĸ�����жϺ����������ˮ��Һ�еĵ���ƽ���ǽ����ĸ�������Ҫ֪��ǿ����ʣ����Ӽ���ǿ���Լ�����ȫ���룻������ʣ����Լ������ֵ��룻��������ʷ����������ӵ����ʵ��ڽ�ϳɷ��ӵ�����ʱ��������ʵĵ���ʹ��ڵ���ƽ��״̬������ƽ���ǻ�ѧƽ���һ�֣�ͬ�����л�ѧƽ��������������ı�ʱƽ���ƶ��Ĺ��ɷ�����ɳ����ԭ����


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��̽��ľ̿��ŨH2SO4��Ӧ�IJ������Ƿ����CO2��ijͬѧѡ����ͼ��ʾװ�ý���ʵ��:
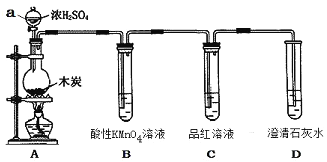
��1������a������Ϊ:___________������װ������ʵ��װ�ú���װ��ҩƷ֮ǰ�����ʵ�������___________��
��2��д��A�з�����Ӧ�Ļ�ѧ����ʽ_______________��
��3��װ��B��������_______����װ���з����Ļ�ѧ��Ӧ��˵��SO2����_______________�ԡ�
��4����֪SO2Ҳ����ʹ�����ʯ��ˮ����ǣ�����˵��������һ������CO2�����ʵ������Ϊ______________��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����е����ֹ�̬�����ۻ�����������ʱ���˷������������������ͬ�����͵��ǣ� ��
A.����Ȼ���
B.���ʯ���ؾ�ʯ
C.��������ɱ�
D.��֬��������ͱ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
���е��ʲμӻ����ɵķ�Ӧһ����������ԭ��Ӧ
����Al2(SO4)3��Һ����εμ�Ba(OH)2��Һ�������ɰ�ɫ�������������ʧ
������BaCl2��NaOH�Ļ����Һ��ͨ�������Ķ����������壬�а�ɫ��������
����CaCl2��Һ��ͨ������������̼���壬�����ɰ�ɫ�������������ʧ
��101kPa��150��ʱ��agCO��H2�Ļ��������������O2����ȫȼ�գ���ȼ�պ�IJ���ͨ��������Na2O2�����Na2O2����ag
��Ϊ�ⶨ�����������Ƶĵ����ԣ����ڸ���(��Ҫ�ɷ���Al2O3) �������ۻ��������ƹ������в���
����������һ���ǽ���������
��22.4L��CO�����28gN2�����ĵ��������
A. �٢ڢܢޢ� B. �ۢܢ� C. �٢ݢޢ� D. �ۢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ����в����ɽ���������ֱ�ӷ�Ӧ�Ƶõ��ǣ� ��
A. �Ȼ�ͭ B. �Ȼ����� C. ���Ȼ��� D. ���Ȼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��R���ӵ�����Ϊa g���������ΪM����M��a�ı�ֵ����
A.6.02��1023B.12Cԭ��������ʮ����֮һ
C.0.012kg12C������ԭ����D.1mol��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�����Ҫ�Ļ���ԭ�ϣ��ֿ���Ϊȼ�ϣ����úϳ�������Ҫ�ɷ�ΪCO��CO2��H2���ڴ����������ºϳɼ״�������������Ӧ���£�
��CO��g��+2H2��g��CH3OH��g����H1
��CO2��g��+3H2��g��CH3OH��g��+H2O��g����H2=��58kJ/mol
��CO2��g��+H2��g��CO��g��+H2O��g����H3
�ش��������⣺
��1�����ʵı��������dz��õĻ�ѧ����ѧ���ݣ������������㻯ѧ��Ӧ�ȣ�����ѧ��Ӧ�ȣ���H=��������������ۺϩ���Ӧ����������ܺͣ�
��֪�������ʵı������������
���� | CO | CO2 | H2 | CH3OH��g�� |
�������ȣ�kJ/mol�� | ��110.52 | ��393.51 | 0 | ��201.25 |
A�������H1=kJ/mol B����H30����=����������
��2���ɼ״���һ���������Ʊ����ѣ�һ���¶��£������������Ϊ1.0L�ĺ����ܱ������з�����Ӧ��2CH3OH��g��CH3OCH3��g��+H2O��g����ʵ�����ݼ�����
������� | �¶ȣ��棩 | ��ʼ���ʵ�����mol�� | ƽ�����ʵ�����mol�� | |||
CH3OH��g�� | CH3OCH3��g�� | H2O��g�� | CH3OCH3��g�� | H2O��g�� | ||
a | 387 | 0.20 | 0 | 0 | 0.080 | 0.080 |
b | 387 | 0.40 | 0 | 0 | ||
c | 207 | 0.20 | 0 | 0 | 0.090 | 0.090 |
����˵����ȷ����
A.�÷�Ӧ������ӦΪ���ȷ�Ӧ
B.�ﵽƽ��ʱ������a�е�CH3OH�������������b�е�С
C.����a�з�Ӧ����ƽ������ʱ�������c�еij�
D.����ʼʱ������a�г���CH3OH 0.15mol��CH3OCH3 0.15mol��H2O 0.10mol����Ӧ��������Ӧ�������
��3���ϳ�������� ![]() =2.60ʱ����ϵ�е�COƽ��ת���ʣ��������¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
=2.60ʱ����ϵ�е�COƽ��ת���ʣ��������¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
�٦���CO��ֵ���¶����߶��������С��������ԭ���� ��
��ͼ��P1��P2��P3�Ĵ�С��ϵΪ �� ���ж������� ��
��4���״������Ƴ�ȼ�ϵ�أ���ϳ����Ƴ�ȼ�ϵ������ŵ��ǣ�������������Ϊ������为����ӦΪ�� �� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У�����ȷ���ǣ� ��
A.
��������ˮĤ�����Ժ���������ԣ�����������ʴ
B.
��������ˮĤ�����Խ�ǿ���������ⸯʴ
C.
��п�廻��ͭ��Ը�բ�ű���Ч������
D.
��բ����Ϊ�������ܵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ�������й���Һ�����ӵ����ʵ���Ũ�ȹ�ϵ��ȷ���ǣ� ��
A.0.1mol/LCH3COONa��0.1mol/LHCl��Һ�������ϣ�c��Na+��=c��Cl������c��OH������cCH3COO����
B.0.1mol/LNH4Cl��0.1mol/L��ˮ�������ϣ�pH��7����c��NH3?H2O����c��NH4+����c��Cl������c��OH����
C.0.1mol/LNa2CO3��0.1mol/L NaHCO3��Һ�������ϣ� ![]() c��Na+��=c��CO32����+c��HCO3����+c��H2CO3��
c��Na+��=c��CO32����+c��HCO3����+c��H2CO3��
D.0.1mol/LNa2C2O4��0.1mol/LHCl��Һ�������ϣ�H2C2O4Ϊ��Ԫ���ᣩ��2c��C2O42����+c��HC2O4����+c��OH����=c��Na+��+c��H+��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com