
【题目】R分子的质量为a g,相对质量为M,则M与a的比值等于
A.6.02×1023B.12C原子质量的十二分之一
C.0.012kg12C所含的原子数D.1mol氧气所含的微粒数
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
【题目】判断一个反应是否为氧化还原反应的标准是( )
A.是否有氧元素参加反应
B.是否为置换反应
C.元素的化合价在反应前后是否发生变化
D.是否为化合反应或分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用二氧化锰跟浓盐酸共热反应制取氯气,化学方程式是 4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O,HCl 所起的作用有:_____________________。
Cl2↑+MnCl2+2H2O,HCl 所起的作用有:_____________________。
(2)KMnO4是常用的氧化剂。用高锰酸钾跟浓盐酸在室温下制氯气的化学方程式是:2 KMnO4 + 16 HCl == 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O ,用双线桥法表示该反应方程式的电子得失情况_____________。
(3)历史上曾用“地康法”制氯气。这一方法是用 CuCl2 作催化剂,在 450℃利用空气中的氧气跟氯化氢反应制氯气。这一反应的化学方程式为_____________________。
(4)若要制得 71g 氯气,则三种方法被氧化的 HCl 物质的量之比是_________,参与反应的 HCl 质量之比是_____________________。
(5)比较以上三个反应,氧化剂的氧化能力从强到弱的顺序为 KMnO4>MnO2>O2,你认为得到这个顺序的依据是:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH标准溶液的配制和标定,需经过NaOH溶液配制、基准物质H2C2O42H2O的称量以及用NaOH溶液滴定等操作.下列有关说法正确的是( )
A.
用图所示操作转移NaOH溶液到容量瓶中
B.
用图所示装置准确称得0.1575gH2C2O42H2O固体
C. 用
用
图所示操作排除碱式滴定管中的气泡
D.
用图所示装置以NaOH待测液滴定H2C2O4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电解质中,①NaCl; ②NaOH;③NH3H2O; ④CH3COOH; ⑤BaSO4⑥H2O
(1)是弱电解质(填序号);
(2)pH相同的NaOH溶液与氨水,加水稀释相同的倍数后,pH大的是
(3)有pH均为2的盐酸、硫酸和醋酸三种溶液:盐酸和醋酸的浓度大小顺序为:
C(HCl)(CH3COOH)(填<、>或=),若分别用这三种酸中和含等物质的量的NaOH的溶液,所需酸的体积分别为a、b、c,则他们的关系是 .
(4)25℃时,有0.01mol/L的醋酸溶液,CH3COOH的电离方程式醋酸的电离平衡常数表达式 , 达平衡时溶液中氢离子的浓度(25℃,醋酸的电离常数为1.6×10﹣5;醋酸的电离程度很小,可近似认为醋酸的浓度不变).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒鼓回收料含硒约97%,其余为约3%的碲和微量的氯.从该回收料中回收硒的工艺流程如图所示(已知煅烧过程中,回收料中的硒、碲被氧化成SeO2和TeO2): 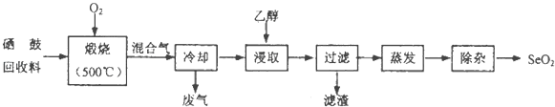
部分物质的物理性质如表:
物质 | 熔点 | 沸点 | 溶解度 |
SeO2 | 340℃(315℃升华) | 684℃ | 易溶于水和乙醇 |
TeO2 | 733℃(450℃升华) | 1260℃ | 微溶于水,不溶于乙醇 |
回答下列问题:
(1)Se与S是同族元素,比S多1个电子层,Se在元素周期表的位置为;H2Se的热稳定性比H2S的热稳定性(填“强”或“弱”).
(2)乙醇浸取后过滤所得滤渣的主要成分是 . 蒸发除去溶剂后,所得固体中仍含有少量TeO2杂质,除杂时适宜采用的方法是 .
(3)SeO2易溶于水得到H2SeO3溶液,向溶液中通入HI气体后,再加入淀粉溶液,溶液变蓝色,同时生成Se沉淀,写出反应的化学方程式 .
(4)已知H2SeO3的电离常数K1=3.5×10﹣3、K2=5.0×10﹣8 , 回答下列问题:
①Na2SeO3溶液呈性,原因是(用离子方程式表示);
②在Na2SeO3溶液中,下列关系式正确的是:
A.c(Na+)+c(H+)=c(SeO32﹣)+c(HSeO3﹣)+c(OH﹣)
B.2c(Na+)=c(SeO32﹣)+c(HSeO3﹣)+c(H2SeO3)
C.c(Na+)=2c(SeO32﹣)+2c(HSeO3﹣)+2c(H2SeO3)
D.c(OH﹣)=c(H+)+c(HSeO3﹣)+c(H2SeO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铜加入一定量稀硫酸和过氧化氢混合溶液中,充分反应后,溶液呈蓝色,有无色气体产生;若还发现容器底部有少量固体,则该固体可能是
A.CuB.SC.CuSD.Cu2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于相同物质的量的SO2和SO3,下列说法正确的是 ( )
A. 硫元素的质量比为5∶4B. 分子数之比为1∶1
C. 原子总数之比为4∶3D. 质量之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1molL﹣1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1molL﹣1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图: 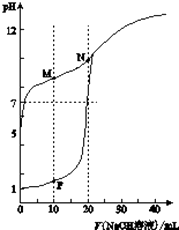
(1)HX为酸(填“强”或“弱”).
(2)N点pH>7的原因是(用化学用语表示) .
(3)下列说法正确的是(填字母).
a.M点c(HX)<c(X﹣)
b.M点c(Na+)>c(OH﹣)
c.P点c(Cl﹣)=0.05molL﹣1 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com