
ЁОЬтФПЁПЮјЙФЛиЪеСЯКЌЮјдМ97%ЃЌЦфгрЮЊдМ3%ЕФэкКЭЮЂСПЕФТШЃЎДгИУЛиЪеСЯжаЛиЪеЮјЕФЙЄвеСїГЬШчЭМЫљЪОЃЈвбжЊьбЩеЙ§ГЬжаЃЌЛиЪеСЯжаЕФЮјЁЂэкБЛбѕЛЏГЩSeO2КЭTeO2ЃЉЃК 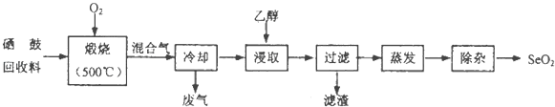
ВПЗжЮяжЪЕФЮяРэаджЪШчБэЃК
ЮяжЪ | ШлЕу | ЗаЕу | ШмНтЖШ |
SeO2 | 340ЁцЃЈ315ЁцЩ§ЛЊЃЉ | 684Ёц | взШмгкЫЎКЭввДМ |
TeO2 | 733ЁцЃЈ450ЁцЩ§ЛЊЃЉ | 1260Ёц | ЮЂШмгкЫЎЃЌВЛШмгкввДМ |
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉSeгыSЪЧЭЌзхдЊЫиЃЌБШSЖр1ИіЕчзгВуЃЌSeдкдЊЫижмЦкБэЕФЮЛжУЮЊЃЛH2SeЕФШШЮШЖЈадБШH2SЕФШШЮШЖЈадЃЈЬюЁАЧПЁБЛђЁАШѕЁБЃЉЃЎ
ЃЈ2ЃЉввДМНўШЁКѓЙ§ТЫЫљЕУТЫдќЕФжївЊГЩЗжЪЧ ЃЎ еєЗЂГ§ШЅШмМСКѓЃЌЫљЕУЙЬЬхжаШдКЌгаЩйСПTeO2дгжЪЃЌГ§дгЪБЪЪвЫВЩгУЕФЗНЗЈЪЧ ЃЎ
ЃЈ3ЃЉSeO2взШмгкЫЎЕУЕНH2SeO3ШмвКЃЌЯђШмвКжаЭЈШыHIЦјЬхКѓЃЌдйМгШыЕэЗлШмвКЃЌШмвКБфРЖЩЋЃЌЭЌЪБЩњГЩSeГСЕэЃЌаДГіЗДгІЕФЛЏбЇЗНГЬЪН ЃЎ
ЃЈ4ЃЉвбжЊH2SeO3ЕФЕчРыГЃЪ§K1=3.5ЁС10Љ3ЁЂK2=5.0ЁС10Љ8 ЃЌ ЛиД№ЯТСаЮЪЬтЃК
ЂйNa2SeO3ШмвКГЪадЃЌдвђЪЧЃЈгУРызгЗНГЬЪНБэЪОЃЉЃЛ
ЂкдкNa2SeO3ШмвКжаЃЌЯТСаЙиЯЕЪНе§ШЗЕФЪЧЃК
AЃЎcЃЈNa+ЃЉ+cЃЈH+ЃЉ=cЃЈSeO32ЉЃЉ+cЃЈHSeO3ЉЃЉ+cЃЈOHЉЃЉ
BЃЎ2cЃЈNa+ЃЉ=cЃЈSeO32ЉЃЉ+cЃЈHSeO3ЉЃЉ+cЃЈH2SeO3ЃЉ
CЃЎcЃЈNa+ЃЉ=2cЃЈSeO32ЉЃЉ+2cЃЈHSeO3ЉЃЉ+2cЃЈH2SeO3ЃЉ
DЃЎcЃЈOHЉЃЉ=cЃЈH+ЃЉ+cЃЈHSeO3ЉЃЉ+cЃЈH2SeO3ЃЉ
ЁОД№АИЁП
ЃЈ1ЃЉЕкЫФЃЈЛђ4ЃЉжмЦкЂіAзхЃЛШѕ
ЃЈ2ЃЉTeO2ЃЛЩ§ЛЊ
ЃЈ3ЃЉH2SeO3+4HI=SeЁ§+2I2+3H2O
ЃЈ4ЃЉМюЃЛSeO32Љ+H2O?HSeO3Љ+OHЉЃЛC
ЁОНтЮіЁПНтЃКЃЈ1.ЃЉSeгыSЪЧЭЌзхдЊЫиЃЌБШSЖр1ИіЕчзгВуЃЌдђSeКЫЭтКЌга4ИіЕчзгВуЃЌзюЭтВуКЌга6ИіЕчзгЃЌдкдЊЫижмЦкБэжаЮЛгкЕкЫФжмЦкЁЂЂіAзхЃЛЭЌвЛжїзхжаЗЧН№Ъєадж№НЅМѕШѕЃЌдђЗЧН№ЪєадSЃОSeЃЌЫљвдH2SeЕФШШЮШЖЈадБШH2SЕФШШЮШЖЈадШѕЃЌЫљвдД№АИЪЧЃКЕкЫФЃЈЛђ4ЃЉжмЦкЂіAзхЃЛШѕЃЛ
ЃЈ2.ЃЉьбЩеКѓВњЮяЕФжївЊГЩЗжЮЊЃККЭTeO2 ЃЌ гЩгкTeO2ЮЂШмгкЫЎЃЌВЛШмгкввДМЃЌЫљвдввДМНўШЁКѓЙ§ТЫЫљЕУТЫдќЕФжївЊГЩЗжЪЧTeO2ЃЛгЩгкSeO2взЩ§ЛЊЃЌдђГ§ШЅSeO2жаЩйСПTe02дгжЪЃЌПЩЭЈЙ§Щ§ЛЊЕФЗНЗЈЃЌЫљвдД№АИЪЧЃКTeO2ЃЛЩ§ЛЊЃЛ
ЃЈ3.ЃЉH2SeO3ШмвКгыHIЦјЬхЩњГЩЕтЕЅжЪКЭSeГСЕэЃЌЛЏбЇЗНГЬЪНЃКH2SeO3+4HI=SeЁ§+2I2+3H2OЃЌЫљвдД№АИЪЧЃКH2SeO3+4HI=SeЁ§+2I2+3H2OЃЛ
ЃЈ4.ЃЉЂйH2SeO3ЪЧШѕЫсЃЌЫЎНтГЪМюадЃЌSeO32Љ+H2OHSeO3Љ+OHЉ ЃЌ ЫљвдД№АИЪЧЃКМюЃЛSeO32Љ+H2OHSeO3Љ+OHЉЃЛЂкAЃЎcЃЈSeO32ЉЃЉДјСНИіЕчКЩЃЌгІЮЊcЃЈNa+ЃЉ+cЃЈH+ЃЉ=2cЃЈSeO32ЉЃЉ+cЃЈHSeO3ЉЃЉ+cЃЈOHЉЃЉЃЌЙЪAДэЮѓЃЛ BCЃЎФЦдзгИіЪ§ЮЊSeИіЪ§ЕФЖўБЖЃЌcЃЈNa+ЃЉ=2cЃЈSeO32ЉЃЉ+2cЃЈHSeO3ЉЃЉ+2cЃЈH2SeO3ЃЉЃЌЙЪBДэЮѓЁЂЙЪCе§ШЗЃЛDЃЎИљОнжЪзгЪиКуПЩЕУЃКcЃЈOHЉЃЉ=cЃЈHCO3ЉЃЉ+2cЃЈH2CO3ЃЉ+cЃЈH+ЃЉЃЌЙЪDДэЮѓЃЎЫљвдД№АИЪЧЃКCЃЎ


 УПШе10ЗжжгПкЫуаФЫуЫйЫуЬьЬьСЗЯЕСаД№АИ
УПШе10ЗжжгПкЫуаФЫуЫйЫуЬьЬьСЗЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНЋвЛЖЈжЪСПЕФУОЭКЯН№МгШыЕН100mLФГХЈЖШHNO3ШмвКжаЃЌСНепЧЁКУЗДгІЃЌМйЩшЗДгІЕФЛЙдВњЮяжЛгаNOЦјЬхЃЌЯђЫљЕУШмвКжаМгШыЮяжЪЕФСПХЈЖШЮЊ3mol/L NaOHШмвКжСГСЕэЭъШЋЃЌВтЕУЩњГЩГСЕэЕФжЪСПБШдКЯН№ЕФжЪСПдіМг5.1gЃЌдђЯТСагаЙиа№Ъіжае§ШЗЕФЪЧЃЈ ЃЉ
A.МгШыКЯН№ЕФжЪСПВЛПЩФмЮЊ6.6g
B.ВЮМгЗДгІЕФЯѕЫсЕФЮяжЪЕФСПХЈЖШЮЊ1mol/L
C.ЩњГЩГСЕэЭъШЋЪБЯћКФNaOHШмвКЕФЬхЛ§ЮЊ100 mL
D.ЩњГЩNOЦјЬхЬхЛ§ЮЊ2.24 L
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПжЦШЁАБЦјВЂЭъГЩгыАБЦјадЯрЙиЕФЪЕбщЃЈЭМжаМаГжзАжУОљвбТдШЅЃЉЁЃ
ЃЈ1ЃЉаДГіЪЕбщЪвжЦШЁАБЦјЕФЛЏбЇЗНГЬЪН________________ЁЃ
ЃЈ2ЃЉвЊЕУЕНИЩдяЕФАБЦјПЩбЁгУ__________зіИЩдяМСЃЈЬюађКХЃЉ
AЃЎЮоЫЎ CaCl2 BЃЎХЈСђЫс CЃЎP2O5 DЃЎМюЪЏЛв
ЃЈ3ЃЉвбжЊАБЦјФбШмгкгаЛњШмМС CCl4ЁЃЯТСазАжУжаПЩвдзі NH3ЕФЮВЦјЮќЪезАжУЕФга______ЁЃ
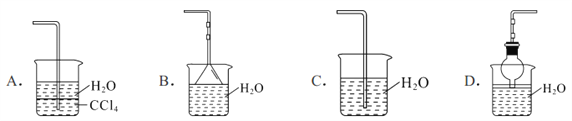
ЃЈ4ЃЉШчЙћжЛЬсЙЉШчЭМЕФзАжУЃЌЧыЫЕУїв§ЗЂХчШЊЕФЗНЗЈ___________ЁЃ
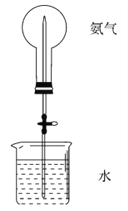
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
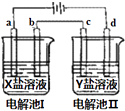
ЁОЬтФПЁПШчЭМЫљЪОЕФЕчНтГиIКЭЂђжаЃЌaЁЂbЁЂcКЭdОљЮЊPtЕчМЋЃЎЕчНтЙ§ГЬжаЃЌЕчМЋbКЭdЩЯУЛгаЦјЬхвнГіЃЌЕЋжЪСПОљдіДѓЃЌЧвдіжиbЃОdЃЎЗћКЯЩЯЪіЪЕбщНсЙћЕФбЮШмвКЪЧЃЈ ЃЉ
бЁЯю | X | Y |
A | AgNO3 | CuЃЈNO3ЃЉ2 |
B | MgSO4 | CuSO4 |
C | FeSO4 | Al2ЃЈSO4ЃЉ3 |
D | CuSO4 | AgNO3 |
A.A
B.B
C.C
D.D
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПRЗжзгЕФжЪСПЮЊa gЃЌЯрЖджЪСПЮЊMЃЌдђMгыaЕФБШжЕЕШгк
A.6.02ЁС1023B.12CдзгжЪСПЕФЪЎЖўЗжжЎвЛ
C.0.012kg12CЫљКЌЕФдзгЪ§D.1molбѕЦјЫљКЌЕФЮЂСЃЪ§
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊ298KЃЌ1.01ЁС105PaЬѕМўЯТЃК2H2ЃЈgЃЉ+O2ЃЈgЃЉЈT2H2OЃЈgЃЉЁїH=Љ483.6kJmolЉ1ЃЛCOЃЈgЃЉ+ ![]() O2ЃЈgЃЉЈTCO2ЃЈgЃЉЁїH=Љ282.9kJmolЉ1дђИУЬѕМўЯТCOЃЈgЃЉ+H2OЃЈgЃЉЈTH2ЃЈgЃЉ+CO2ЃЈgЃЉЕФЗДгІШШЪЧЃЈ ЃЉ
O2ЃЈgЃЉЈTCO2ЃЈgЃЉЁїH=Љ282.9kJmolЉ1дђИУЬѕМўЯТCOЃЈgЃЉ+H2OЃЈgЃЉЈTH2ЃЈgЃЉ+CO2ЃЈgЃЉЕФЗДгІШШЪЧЃЈ ЃЉ
A.Љ41.1 kJmolЉ1
B.+200.7 kJmolЉ1
C.Љ766.5 kJmolЉ1
D.+41.1 kJmolЉ1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈВЛе§ШЗЕФЪЧЃЈ ЃЉ
A. ТШРызгЕФЕчзгВуНсЙЙИњыВдзгЯрЭЌ B. ТШРызгБШТШдзгЮШЖЈ
C. ТШЦјгаЖОЃЌгаЧПСвЕФДЬМЄад D. ТШдЊЫиГЪЛЦТЬЩЋ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪвЮТЯТЃЌгУФГХЈЖШNaOHШмвКЕЮЖЈвЛдЊЫсHAЕФЕЮЖЈЧњЯпШчЭМЫљЪОЃЈКсзјБъЮЊЕЮШыNaOHЕФЬхЛ§ЃЌзнзјБъЮЊЫљЕУЛьКЯвКЕФpHЃЉЃЎЯТСаХаЖЯе§ШЗЕФЪЧЃЈ ЃЉ 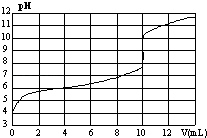
A.HAЕФХЈЖШЮЊ1ЁС10Љ4molLЉ1
B.ЪЕбщЪБПЩбЁМзЛљГШзїжИЪОМС
C.pH=7ЪБЃЌШмвКжаcЃЈNa+ЃЉЃОcЃЈAЉЃЉ
D.V=10mLЃЌЫсМюЧЁКУжаКЭ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПCO(g)гыH2O(g)ЗДгІЙ§ГЬЕФФмСПБфЛЏШчЭМЫљЪОЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ

AЃЎИУЗДгІЮЊЮќШШЗДгІ
BЃЎCO(g)КЭH2O(g)ЕФзмФмСПДѓгкCO2(g)КЭH2(g)ЕФзмФмСП
CЃЎИУЗДгІЕФШШЛЏбЇЗНГЬЪНЃКCO(g)+H2O(g)![]() CO2(g)+H2(g) ІЄH=+41 kJ/mol
CO2(g)+H2(g) ІЄH=+41 kJ/mol
DЃЎ1 mol CO2(g)КЭ1 mol H2(g)ЗДгІЩњГЩ1 mol CO(g)КЭ1 mol H2O(g)вЊЗХГі41 kJЕФШШСП
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com