
��13�֣�
��1����һ���������İ�������������ܱ���������У���������������䣬��������������Բ��ƣ����ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺H2NCOONH4(s) 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
ʵ���ò�ͬ�¶��µ�ƽ�����������±���
�¶�(��) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
ƽ��������Ũ��(��10-3 mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
��������立ֽⷴӦ���ʱ䦤H 0���>������<����=������
�����жϸ÷ֽⷴӦ�Ѿ��ﵽ��ѧƽ����� ��(����ĸ)
A��2v(NH3)=v(CO2) B���ܱ���������ѹǿ����
C���ܱ������л��������ܶȲ��� D���ܱ������а����������������
���ݱ������ݣ�����25.0��ʱ�ķֽ�ƽ�ⳣ��Ϊ ��
��2��25��ʱ��NH3��H2O���볣��Kb=1.8��10-5��Mg(OH)2���ܶȻ�����Ksp=1.8��10-11������0.5 mol/L��ˮ��pHԼΪ ������֪lg3��0.5����ij�Ȼ�þ��Һ�м���һ������ijŨ�ȵİ�ˮ��û��ҺPH=11������¶��²�������Һ�е�c(Mg2+)= ��
��1����> (2��) ��B��C(2��) ��1.64��10-8mol3/L3(3�֣���д��λ��1��)
��2��11.5 (3��) 1.8��10-5mol/L (3�֣���д��λ��1��)
��������
�����������1�����������¶ȣ�ƽ��������Ũ������˵�������¶ȣ�ʹ��������立ֽⷴӦ�����ƶ�������ƽ���ƶ�ԭ���������¶�ƽ�������ȷ�Ӧ�����ƶ�����������Ӧ�����ȷ�Ӧ���ʦ�H>0����A�����κ�ʱ�̶�����2v(NH3)=v(CO2)�����Բ����жϷ�Ӧ�ﵽƽ��״̬������B�������ܱ��������ݻ����䣬���Ҹ÷�Ӧ�Ƿ�Ӧǰ������������ȵķ�Ӧ����������������ѹǿ���䣬��Ӧ�ﵽƽ��״̬����ȷ��C�������������ܼ����䣬����Ӧǰ����������������仯���������ܱ������л��������ܶȲ��䣬��������������䣬��Ӧ�ﵽƽ��״̬����ȷ��D�����ڷ�Ӧ���ǹ��壬�����еİ����������̼�����ʵ����ıȺ㶨��2:1���뷴Ӧ�Ƿ�ﵽƽ���أ�����ܱ������а���������������䲻����Ϊ�жϷ�Ӧ�ﵽƽ��ı�־��������25.0��ʱƽ��������Ũ����4.8��10-3mol/L����c(NH3)=3.2mol/L��c(CO2)=1.6mol/L���������ʷֽ�ƽ�ⳣ��ΪK= c2(NH3)��c(CO2)= (3.2��10-3mol/L)2��1.6��10-3mol/L =1.64��10-8mol3/L3; ��2��25��ʱ��NH3��H2O���볣��Kb=1.8��10-5,Kb=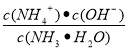 =1.8��10-5,����һˮ�ϰ��ĵ���̶Ⱥ�С��������0.5 mol/L �İ�ˮ��c2(OH-)=1.8��10-5��0.5=9��10-6 (mol/L), c (OH-)=3��10-3 mol/L,��������ˮ�����ӻ�������1��10-14������c(H+)=(1��10-14)��(3��10-3)=1/3��10-11������pH=11+0.5=11. 5��Mg(OH)2���ܶȻ�����Ksp=1.8��10-11����c(Mg2+)��c2(OH-)=1.8��10-11,��Һ��pH=11����c (OH-)=1��10-3 mol/L, c(Mg2+)=1.8��10-11��c2(OH-)=1.8��10-11��(1��10-3)2=1.8��10-5(mol/L)��
=1.8��10-5,����һˮ�ϰ��ĵ���̶Ⱥ�С��������0.5 mol/L �İ�ˮ��c2(OH-)=1.8��10-5��0.5=9��10-6 (mol/L), c (OH-)=3��10-3 mol/L,��������ˮ�����ӻ�������1��10-14������c(H+)=(1��10-14)��(3��10-3)=1/3��10-11������pH=11+0.5=11. 5��Mg(OH)2���ܶȻ�����Ksp=1.8��10-11����c(Mg2+)��c2(OH-)=1.8��10-11,��Һ��pH=11����c (OH-)=1��10-3 mol/L, c(Mg2+)=1.8��10-11��c2(OH-)=1.8��10-11��(1��10-3)2=1.8��10-5(mol/L)��
���㣺���黯ѧ��Ӧ����ЧӦ����ѧƽ��״̬���жϡ�ƽ�ⳣ���ļ��㼰����ƽ�ⳣ�����ܶȻ�������Ӧ�õ�֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���Ĵ�ʡ��һ10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
Ϊ�˳�ȥ�����е�Ca2����Mg2����SO42-����ɳ�õ�������NaCl���ɽ���������ˮ��Ȼ�������в�����ѡȡ��Ҫ�IJ������ȷ�IJ���˳��
�ٹ��� �ڼӹ���NaOH��Һ �ۼ��������� �ܼӹ���Na2CO3��Һ �ݼӹ���BaCl2��Һ
A���٢ۢܢڢ� B���ܢ٢ڢݢ� C���ڢݢܢ٢� D���٢ܢڢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���Ĵ�ʡ�ɶ������ѧУ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ѧ�Ҷ�ԭ�ӽṹ����ʶ˳����ȷ����
�ٵ�����ԭ��ģ�� ����ķ��ԭ��ģ�� ��¬ɪ��ԭ��ģ�� �ܵ�����ģ��
A���٢ۢڢ� B���ܢ٢ڢ� C���٢ڢۢ� D���ܢڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���Ĵ��ɶ�����Э����ѧ�߶�10�½��Կ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
X��Y������Ԫ�أ�IΪ�����ܣ���λ��kJ/mol�������±����������жϴ������
Ԫ�� | I1 | I2 | I3 | I4 |
X | 500 | 4600 | 6900 | 9500 |
Y | 580 | 1800 | 2700 | 11600 |
A��Ԫ��Y�ij������ϼ���+3��
B��Ԫ��X�Ǣ�A���Ԫ��
C��Ԫ��X�����γɻ�����ʱ����ѧʽ������X2O2
D����Ԫ��Y���ڵ�3���ڣ���������ˮ���ҷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���Ĵ��ɶ�����Э����ѧ�߶�10�½��Կ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������½ṹ��ԭ�ӣ�һ����������Ԫ�ص���
A���������8�����ӵ�ԭ�� B�����������Ų�Ϊns2��ԭ��
C���������3��δ�ɶԵ��ӵ�ԭ�� D���������δ�ɶԵ��ӵ�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꼪��ʡ�������¸��������п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��һ���¶��£�������X������Y��0.16 mol����10 L�����ܱ������У�������Ӧ��X(g)��Y(g) 2Z(g) ��H<0��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ���������±���
2Z(g) ��H<0��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ���������±���
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
����˵����ȷ����
A����Ӧǰ2 min��ƽ�����ʦ�(Z)=2.0��10-3 mol��L-1��min-1
B�������������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰ��(��)>��(��)
C�����������������䣬��ʼʱ�������г���0.32 mol����X��0.32 mol ����Y������ƽ��ʱ��n(Z)<0.24 mol
D�������������䣬��ƽ����ϵ���ٳ���0.16 mol����X����ԭƽ����ȣ��ﵽ��ƽ��ʱ������Y��ת��������X�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꼪��ʡ�������¸��������п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�л���A�IJ����Ǻ���һ������ʯ��ҵ��չˮƽ�ı�־���ɷ�������ϵ��ת���� B��D�������г����������л������˵������ȷ����

A��A�Ľṹ��ʽΪCH2=CH2
B��1molB���ʿ���������Na��Ӧ����0.5molH2
C��B��D��E�������ʿ����ñ���Na2CO3��Һ����
D����B��D�Ʊ�EŨH2SO4ֻ����ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꼪��ʡ���������ѧУ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
���й���ú��ʯ�͡���Ȼ������Դ��˵����ȷ����
A��ʯ���ѽ�õ��������Ǵ�����
B��ʯ�Ͳ�Ʒ�������ھۺϷ�Ӧ
C����Ȼ����һ�����Ļ�ʯȼ��
D��ˮú����ͨ��ú��Һ���õ�������ȼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꼪��ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ������
��12�֣��������ᣬ��һ���¶��´ﵽ����ƽ��ʱ��������Ũ�ȴ�����һ�ֶ�����ϵ����25 ��ʱ��HA H����A������K��
H����A������K��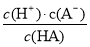 ��ʽ��KΪ����ƽ�ⳣ����ֻ���¶��йأ�cΪƽ��Ũ�ȡ��±��Ǽ�������ĵ���ƽ�ⳣ��(25 ��)��
��ʽ��KΪ����ƽ�ⳣ����ֻ���¶��йأ�cΪƽ��Ũ�ȡ��±��Ǽ�������ĵ���ƽ�ⳣ��(25 ��)��
�� | ���뷽��ʽ | ����ƽ�ⳣ��K |
CH3COOH | CH3COOH H����CH3COO�� | 1.75��10��5 |
H2CO3 | H2CO3 HCO3�� | K1��4.4��10��7 K2��4.7��10��11 |
H2S | H2S HS�� | K1��1.3��10��7 K2��7.1��10��15 |
H3PO4 | H3PO4 H2PO4�� HPO42�� | K1��7.1��10��3 K2��6.3��10��8 K3��4.2��10��13 |
�ش��������⣺
��1��Kֻ���¶��йأ����¶�����ʱ��Kֵ________(��������С�����䡱)��
��2�����¶���ͬʱ���������Kֵ��ͬ����ôKֵ�Ĵ�С���������ǿ���Ĺ�ϵ��_____________________________________________________________��
��3������CH3COOH��H2CO3��HCO3����H2S��HS����H3PO4��H2PO4����HPO42���������ᣬ����������ǿ����________��������������________��
��4����Ԫ�����Ƿֲ�����ģ�ÿһ��������Ӧ�ĵ���ƽ�ⳣ��������ͬһ�ֶ�Ԫ�����K1��K2��K3�����У� �������������ԭ����________________________________________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com