
科学家对原子结构的认识顺序正确的是
①道尔顿原子模型 ②汤姆生原子模型 ③卢瑟福原子模型 ④电子云模型
A.①③②④ B.④①②③ C.①②③④ D.④②③①
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源:2014-2015学年四川省邛崃市高二上学期半期考试化学试卷(解析版) 题型:选择题
X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族,其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9 ,单质Y可与NaOH溶液反应生成氢气。下列说法不正确的是
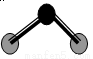
A.原子半径:Y>Z>W
B.XW2熔点为107℃,沸点为142.5℃,说明固态XW2为分子晶体
C.电解YW3固体可得单质Y
D.ZW2分子结构见上图,说明ZW2是极性分子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都外国语学校高二上学期期中化学试卷(解析版) 题型:填空题
某些元素的性质或原子结构信息如下表所示(每空2分,共16分).:
A(短周期) | B(短周期) | C | D(短周期) |
原子最外层上p电子数等于次外层电子数 | 原子最外层有两个未成对电子,其单质为人类生存必需物质 | 单质为生活中常见的金属材料,有紫红色金属光泽 | 单质是常见的半导体材料,广泛应用于IT行业 |
(1)写出A单质与浓硝酸加热反应的化学方程式: 。
(2)写出B元素在周期表中的位置: ,
写出C元素基态原子的电子排布式: _。
(3)写出A与D的氧化物在高温下反应的化学方程式: _。
(4)写出B、D形成的化合物与NaOH溶液反应的离子方程式: 。
(5)比较A、B、D三种元素原子的第一电离能的大小 (由大到小用元素符号表示)。
(6)等电子原理——原子总数相同、价电子总数相同的粒子具有相似的化学键特征,它们的许多性质是相近的。写出二种由多个原子组成的含有与N3-电子数相同的粒子 (分子离子各一种)的化学式 、 。这些粒子空间构型为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
下列提供了有关物质的熔点,根据表中的数据,下列判断错误的是
物质 | NaCl | AlF3 | AlCl3 | MgCl2 | CO2 | SiO2 |
熔点/℃ | 801 | 1291 | 190(2.5×105Pa) | 714 | -56.5 | 1723 |
A.AlF3晶体是离子晶体,AlCl3晶体是分子晶体
B.AlF3晶体的晶格能小于NaCl晶体的晶格能
C.同族元素的氧化物可以形成不同类型的晶体
D.不同族元素的氯化物可以形成相同类型的晶体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
下列对各组物质性质的比较中,正确的是
A.硬度:Li>Na>K
B.熔点:金刚石>晶体硅>二氧化硅>碳化硅
C.第一电离能:Na<Mg<Al
D.空间利用率:六方密堆<面心立方<体心立方
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川成都树德协进中学高二10月阶段性考试化学试卷(解析版) 题型:选择题
下列有关有机物分子的叙述不正确的是
A.乙烯分子中有一个sp2-sp2σ键和一个p-pπ键
B.乙炔每个碳原子都有两个未杂化的2p轨道,它们之间可形成两个π键
C.乙烷两个C原子均是sp3杂化,分子中一共有6个σ键
D.苯分子中的碳原子采用sp2杂化,且每个碳原子均存在一个未参与杂化的p轨道。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川成都树德协进中学高二10月阶段性考试化学试卷(解析版) 题型:选择题
下列原子各电子层中电子数不合理的是
A.Sc:K(2) L(8) M(8) N(3) B. Cr:K(2) L(8) M(13) N(1)
C. Ge:K(2) L(8) M(18) N(4) D. Cu:K(2) L(8) M(18) N(1)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省长春市新高三起点调研考试化学试卷(解析版) 题型:填空题
(13分)
(1)将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:H2NCOONH4(s) 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总浓度(×10-3 mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
氨基甲酸铵分解反应的焓变ΔH 0(填“>”、“<”或“=”)。
可以判断该分解反应已经达到化学平衡的是 。(填字母)
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
根据表中数据,计算25.0℃时的分解平衡常数为 。
(2)25℃时,NH3·H2O电离常数Kb=1.8×10-5,Mg(OH)2的溶度积常数Ksp=1.8×10-11,计算0.5 mol/L氨水的pH约为 。(已知lg3≈0.5)在某氯化镁溶液中加入一定量的某浓度的氨水后,测得混合液PH=11,则此温度下残留在溶液中的c(Mg2+)= 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省长春外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
你认为减少酸雨不可采用的措施是
A.煤脱硫再作燃料 B.开发新能源
C.把工厂烟囱升高 D.多用风能、氢能、核能等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com