
����Ŀ����ˮ���̲��ŷḻ����Դ����ˮ�ۺ����õ�����ͼ��ͼ1�� 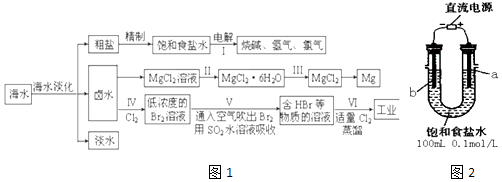
��һ��ij��ѧ�о�С����ͼװ��2ģ�ⲽ��I���ʳ��ˮ ��������ʯī���缫����
��1��a�缫��������������ʯī������缫��ӦʽΪ ��
��2������������11.2mL����ʱ����״����������Һ��pHΪ�����Է�Ӧǰ����Һ����ı仯���� ������±ˮ���̺��ŷḻ��þ��Դ����MgCl2�ֲ�Ʒ���ᴿ��þ��ұ�����̻ش��������⣺��֪MgCl2�ֲ�Ʒ����Һ�к���Fe2+��Fe3+��Al3+ �� ���������������������pH��
���� | Fe��OH��3 | Fe��OH��2 | Al��OH��3 | Mg��OH��2 |
��ʼ����pH | 2.7 | 8.1 | 3.8 | 9.5 |
��ȫ����pH | 3.7 | 9.6 | 4.8 | 11.0 |
��3����MgCl2�ֲ�Ʒ����Һ�е�Fe2+ת��ΪFe3+ �� ������ѡ�õ�������������ţ���ͬ��������������Һ��pH����ַ�Ӧ����ˣ��ɵ�MgCl2��Һ�� a��KMnO4 b��H2O2 c��MgO d��NaOH
��4���������MgCl2H2O���MgCl2�IJ����ǣ� ��
���𰸡�
��1��ʯī��2Cl����2e��=Cl2��
��2��12
��3��b�� c
��4����MgCl2?6H2O�ڸ����HCl�����м���
���������⣺��ˮ�����õ����Ρ�±ˮ���͵�ˮ�����ξ����Ƶõ�����ʳ��ˮ�����ʳ��ˮ�õ��������������������ƣ�±ˮ��������Ũ������ȴ�ᾧ������ϴ�ӵõ��Ȼ�þ���壬�Ȼ���������ʧȥ�ᾧˮ�õ������Ȼ�þ����������Ȼ�þ���ɽ���þ��±ˮ��ͨ���������������������嵥�ʣ�ͨ���ȿ��������嵥��yoga��������ˮ��Һ���գ��õ�HBr����Һ����ͨ����������HBr�����嵥�ʣ��������ã�
��һ����1��װ��ͼ����ֱ����Դ�������ӵĵ缫aΪ��������Һ��������ʧ���ӷ���������Ӧ�����������缫��ӦΪ��2Cl����2e��=Cl2����
���Դ��ǣ�ʯī��2Cl����2e��=Cl2������2����������2H++2e��=H2����22.4mLΪ0.5��10��3mol������������0.001molOH������c��OH����= ![]() =0.01mol/L����ҺpH=12�����Դ��ǣ�12��
=0.01mol/L����ҺpH=12�����Դ��ǣ�12��
��������3����MgCl2�ֲ�Ʒ����Һ�е�Fe2+ת��ΪFe3+����ѡ�õ������ǹ������⡢������������������Ϊ�����ӣ�������ҺPH��ȥ��������Լ��������µ�����Ӧѡ������þ������̼��þ��
���Դ��ǣ�b��c����4�����ֱ���ڿ����м���MgCl26H2O��Mg2+��ˮ�������Mg��OH��Cl��HCl��ͨ��HCl����������ˮ�⣬Ӧ���Ȼ���������ʧˮ����Ȼ�þ���壻
���Դ��ǣ���MgCl26H2O�ڸ����HCl�����м��ȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݱ����������ﰺ�Ŀ�ѧ���������һ��ֻ���ĸ����ӹ��ɵ����ӣ��������ӳ�Ϊ������������Ҳ���˳�֮Ϊ�����Ԫ�����������й��������������ӵ�˵������ȷ����
A.�����Ӳ��Ե���B.��������������ԭ�Ӵ�
C.������������Ϊ4D.�����ڱ�������Ԫ��ռͬһλ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ҫ�ɷ�ΪFeTiO3����������MgO��SiO2�����ʣ���Li4Ti5O12��LiFePO4��������ӵ�صĵ缫���ϣ����������������Ʊ��������������£�

��1����������Ԥ����ʱ��Ҫ���з��飬��ԭ����___________________��
��2�����̢��з�Ӧ�����ӷ���ʽ�ǣ� FeTiO3 + 4H++ 4Cl��== Fe2+ + TiOCl42��+ 2H2O��_______��
��3�����̢��У����Ľ����ʽ����ͼ1��ʾ����ͼ��֪�������Ľ�����Ϊ80%ʱ�������õ�ʵ��������___________________��

��4�����̢��й���TiO2��˫��ˮ����ˮ��Ӧת����(NH4)2Ti5O15��Һʱ��TiԪ�صĽ������뷴Ӧ�¶ȵĹ�ϵ��ͼ2��ʾ����Ӧ�¶ȹ���ʱ��TiԪ�ؽ������½���ԭ����___________��
��5������ҺBת��ΪFePO4���������з������·�Ӧ������ƽ��
Fe2+ +_____ + H3PO4 ===FePO4 + ____ + _____
��6�����̢�����FePO4�Ʊ�LiFePO4�Ļ�ѧ����ʽ��_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ��װ�ý�����Ӧ��ʵ��,���ܴﵽʵ��Ŀ�ĵ���

A. ����ͼ��װ��,�ɿ�����ȡ����
B. ����ͼ��װ�ã��ñ���̼������Һ����CH3CH2OH��CH3COOC2H5���Һ
C. ����ͼ��������֤���ӷ�Ӧ��Ũ�ȶԻ�ѧƽ���Ӱ��
D. ����ͼ��װ�ã���˵��ŨH2SO4������ˮ�ԡ�ǿ�����ԣ�SO2����Ư���ԣ���ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����¡��ݻ�Ϊ1L���������£�����Է�������ת�����䷴Ӧ���̺�������ϵ��ͼ��ʾ[��֪��2SO2��g��+O2��g��2SO3��g����H=��196.6kJ/mol]�� 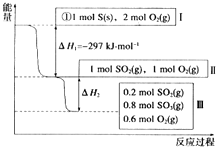
��ش��������⣺
��д���ܱ�ʾ���ȼ���ȵ��Ȼ�ѧ����ʽ�� ��
�ڡ�H2= kJ/mol��
������ͬ�����£�����1mol SO3��0.5mol O2 �� ��ﵽƽ��ʱSO3��ת����Ϊ����ʱ�÷�Ӧ����ų��������ա��� kJ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������NH4Al(SO4)2��12H2O���Ƿ�����ѧ���õĻ��Լ�����ҵ�ϳ�����������Ҫ�ɷ�ΪAl2O3�������������������Z��ˮ��Һ�������˿��������乤������ͼ���£�
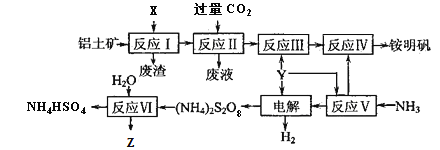
��1��д����Ӧ������ӷ���ʽ____________________��
��2��25��ʱ����0.2 mol��L-1�İ�ˮ��0.1 mol��L-1��Y��Һ�������ϣ�������Һ��pH=5������¶��°�ˮ�ĵ��볣��Kb��_____________�����Ի��ʱ��Һ����ı仯����
��3���ӷ�Ӧ�����������Һ�л������������ʵ���������Ϊ_____________��____________�����ˡ�ϴ�ӣ���������ƣ���
��4������⡱ʱ���ö��Բ������缫���������缫��ӦʽΪ__________________________��
��5����Ӧ���Ļ�ѧ����ʽΪ______________________��
��6����ˮ�к���Fe2����Mn2+�Ƚ������Ӷ���Ȼ���������ص��ƻ����ã�������(NH4)2S2O8������ȥ��д��Mn2+����������MnO2�����ӷ���ʽΪ__________________________________��ZҲ�н�ǿ�����ԣ���ʵ�������в���Z����Mn2+��ԭ����_______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��װ�ý�����Ӧʵ�飬�ܴﵽʵ��Ŀ�ĵ�����
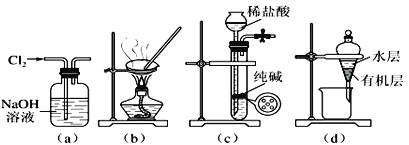
A. ��ͼ(a)��ʾװ�ó�ȥ�����к��е������Ȼ���
B. ��ͼ(b)��ʾװ�������Ȼ�����Һ�Ʊ��Ȼ��ƾ���
C. ��ͼ(c)��ʾװ����ȡ���������Ķ�����̼����
D. ��ͼ(d)��ʾװ�÷��뱽��ȡ��ˮ���ѷֲ���л����ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л������к��еĻ�ѧԪ���������ٵ���
A. ��������� B. ��ά�غ��������� C. �Լ��غ�Ҷ���� D. ATP��ø
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com