
【题目】已知 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表。
元素 | 结构或性质信息 |
X | 原子的L层上s电子数等于p电子数。 |
Y | 原子核外的L层有3个未成对电子。 |
Z | 在元素周期表的各元素中电负性仅小于氟。 |
Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子。 |
R | 核电荷数是Y与Q的核电荷数之和 |
E | 原子序数比R大3 |
请根据信息回答有关问题:
(1)元素Y的原子核外共有_____种不同运动状态的电子,有______种不同能级的电子。
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号)_______。
(3)R的最高化合价为_____________。R的一种配合物的化学式为RCl3·6H2O。
已知0.01 mol RCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.02 mol AgCl沉淀。此配合物最可能是___________。
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2·H2O
C.[R(H2O)4Cl2]Cl·2H2O D.[R(H2O)3Cl3]·3H2O
(4)元素E能形成八面体构型的配合物离子[E (YH3) x Q 2]+,则中心离子为(写化学式)_______,配位体为(写化学式)_______________________,x 的值为______。
【答案】 7 3 O、N、C +6 B CO3+ NH3、Cl— 4
【解析】X元素原子原子的L层上s电子数等于p电子数,核外电子排布为1s22s22p2,则X为C元素;Y元素原子核外的L层有3个未成对电子,核外电子排布为1s22s22p3,则Y为N元素;Z在元素周期表的各元素中电负性仅小于氟,则Z为O元素;Q元素单质常温、常压下是气体,原子的M层上有1个未成对的p电子,原子核外电子排布为1s22s22p63s23p5,则Q为Cl;R核电荷数是Y与Q的核电荷数之和,其核电荷数=7+17=24,则R为Cr;E原子序数比R大3,则E为Co。(1)Y氮元素,原子核外有7个电子,即有7不同运动状态的电子,有3种不同能级的电子;(2)在同周期元素中,从左向右,元素的电负性逐渐增大,所以X、Y、Z三种元素的电负性由高到低的排列次序依次为O、N、C;(3)R为铬元素,它的最高化合价为+6价,根据题意可知,氯化铬(CrCl3![]() 6H2O)和氯化银的物质的量之比是0.01:0.02=1:2,根据氯离子守恒知,则CrCl3
6H2O)和氯化银的物质的量之比是0.01:0.02=1:2,根据氯离子守恒知,则CrCl3![]() 6H2O化学式中含有2个氯离子为外界离子,剩余的1个氯离子是配原子,所以氯化铬(CrCl3
6H2O化学式中含有2个氯离子为外界离子,剩余的1个氯离子是配原子,所以氯化铬(CrCl3![]() 6H2O)的化学式可能为[Cr(H2O)5Cl]Cl2
6H2O)的化学式可能为[Cr(H2O)5Cl]Cl2![]() H2O,答案选B;(4)元素Co形成八面体构型的配合物离子[Co(NH3)xCl2]+中,根据配合物的有关定义可知,中心离子为Co3+,配位体为NH3,由于配合物形成的是八面体结构,所以该配合离子的配位数为6,即x+2=6,可知x 的值为4。
H2O,答案选B;(4)元素Co形成八面体构型的配合物离子[Co(NH3)xCl2]+中,根据配合物的有关定义可知,中心离子为Co3+,配位体为NH3,由于配合物形成的是八面体结构,所以该配合离子的配位数为6,即x+2=6,可知x 的值为4。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】(1)已知:
①N2(g)+O2(g)=2NO(g) △H1= +180.5 kJmol-1
②4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H2=-905 kJmol-1
③2H2(g)+O2(g)=2H2O(g) △H3=-483.6 kJmol-1
请写出N2和H2在高温、高压、催化剂条件下生成NH3的热化学方程式________________。
(2)在一定温度下,某恒容密闭容器中,发生反应:2X(g)+Y(g)![]() 2Z(g) △H<0,各物质的浓度随时间变化如图所示。
2Z(g) △H<0,各物质的浓度随时间变化如图所示。

①从反应开始到4min时平衡,Y的平均反应速率为____________________;
②根据图中数据,4min时的平衡常数K= ______________________;
③若使重新平衡时体系中c(X)=c(Z),则改变的条件为_____________________(只写一项)。
④若某时刻,V正(Y)=2V逆(Z),则反应_____达到平衡(填“已”或“未”)。
⑤图中a、b点对应的正反应速率大小关系为Va________Vb(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
A. 标准状况时,22.4L二氯甲烷所含有的分子数为NA
B. 将16gO2与32gSO2在一定的条件下充分反应生成的SO3分子数为0.5NA
C. lmolNa2O2中含有的阴、阳离子总数是4NA
D. 44g丙烷中含有的非极性键数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着卤素原子半径的增大,下列递变规律正确的是( )
A. 单质的熔、沸点逐渐降低 B. 卤素离子的还原性逐渐增强
C. 单质的氧化性逐渐增强 D. 气态氢化物的稳定性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据新华社消息,卫生部拟从2011年12月1日起,禁止在面粉生产中使用过氧化苯甲酰和过氧化钙。过氧化苯甲酰的结构简式如图所示。

(1)过氧化苯甲酰的分子式为________,其一氯代物共有________种。
(2)工业上可以利用苯甲酰氯(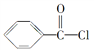 )和双氧水为原料生产过氧化苯甲酰,写出合成过氧化苯甲酰的化学反应方程式:___________________,该反应属于________反应。
)和双氧水为原料生产过氧化苯甲酰,写出合成过氧化苯甲酰的化学反应方程式:___________________,该反应属于________反应。
(3)过氧化苯甲酰用于面粉漂白后会产生苯甲酸:
![]()
![]() 。
。
苯甲酸的同分异构体中,属于酯类的有__________,属于酚类的有_________________ (写结构简式) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于氧化还原反应的是( )
A. 2NaHCO3![]() Na2CO3+CO2↑+H2O B. Na2O+H2O===2NaOH
Na2CO3+CO2↑+H2O B. Na2O+H2O===2NaOH
C. 2KI+Br2===2KBr+I2 D. MgO+2HCl===MgCl2+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com