
【题目】下列说法正确的是
A.需要加热才能发生的反应一定是吸热反应
B.放热反应在常温条件下一定能进行
C.NaOH固体溶于水是放热反应
D.A+B=C+D是放热反应,说明A和B物质的总能量高于C和D的总能量
科目:高中化学 来源: 题型:
【题目】氯酸镁常用作催熟剂、除草剂等,实验室制备Mg(C1O3)2·6H2O 的流程如下:
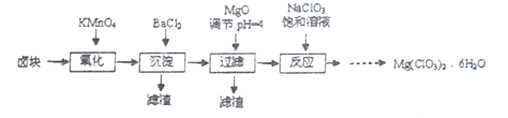
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
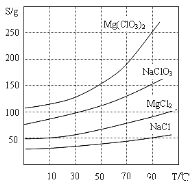
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
(1)过滤所需要的主要玻璃仪器有_________。
(2)加MgO后过滤所得滤渣的主要成分的化学式为_________。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为__________,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:①________;______;洗涤;②将滤液冷却结晶;③过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:(已知Mg(ClO3)2·6H2O的摩尔质量为299 g/mol)
步骤1:准确称量3.50g产品配成100 mL溶液。
步骤2:取10.00mL于锥形瓶中,加入10.00mL稀硫酸和20.00mL1.000mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol/LK2Cr2O7 溶液滴定剩余的Fe2+至终点。反应的方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7 溶液15.00mL。
① 写出步骤2中发生反应的离子方程式__________;
② 产品中Mg(ClO3)2·6H2O的质量分数为_______。(保留到小数点后一位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
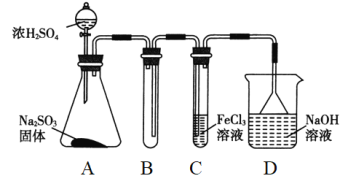
(1)通入足量SO2时C中观察到的现象是______________________。
(2)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式:_______________________;
②请设计实验方案检验有Fe2+生成:_________________________;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-。该做法_____(填“合理”或“不合理”),理由是______。
(3)D装置中倒置漏斗的作用是__________________________。
(4)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填字母)。
a.浓H2SO4 b.酸性KMnO4溶液 c.碘水 d.NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯仿(CHCl3)不溶于水,但在一定条件下水解生成两种酸,其中一种是甲酸(HCOOH)。在19世纪氯仿广泛用于麻醉,可由“乙醛漂白粉法”制得。在光照条件下,氯仿易被空气氧化生成剧毒光气(COCl2)和一种化合物。因此氯仿需要小口钢罐贮存运输,使用前要检验其是否变质。
(1)CHCl3的电子式为__________,HCOOH中C的杂化方式为__________;
(2)漂白粉中三种元素的简单离子的半径的大小顺序为__________(用离子符号表示);
(3)氯仿不溶于水而甲酸易溶于水的原因是__________;
(4)Fe2+的外围电子排布图为__________;
(5)纯铁的一种同素异形体的晶胞为面心立方晶胞,该晶体中原子的配位数为__________,若铁原子的半径为a cm,则该晶体的密度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】24mL浓度为0.05mol/L的Na2SO3溶液,恰好与20mL浓度为0.02mol/L的 K2Cr2O7 溶液完全反应,则元素Cr在还原产物中的化合价是( )
A.+6
B.+3
C.+2
D.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据学过的化学知识填空:
(1)金刚石和石墨物理性质差异较大的原因是____________________;一氧化碳和二氧化碳性质不同的原因是_____________________。
(2)天然气的主要成分燃烧的化学方程式是_________________________。
(3)煤在空气中燃烧需要满足的条件是__________;吹灭蜡烛的原理是____________。
(4)生铁和钢都是铁的合金,由于________不同,二者性能不同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了回收一块质量为40g的铜锌合金中的铜,将该合金放入烧杯中,逐渐加入稀硫酸至不再产生气泡,烧杯内剩余固体27g,求反应中产生气体的质量。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,相同浓度的三种一元弱酸(HX、HY、HZ)、强酸、纯水分别用相同浓度的NaOH 溶液滴定,所得溶液的pH 与滴入NaOH 溶液的体积关系如图所示。已知滴定过程中存在:当c(HX)=c(X-) 时,pH=10;c(HY)=c(Y- )时,pH=7;c(HZ)=c(Z-)时,pH=4。下列说法正确的是( )
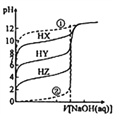
A. ①为强酸的滴定曲线 B. 酸性强弱:HX>HY>HZ
C. 滴定HX溶液可用甲基橙作指示剂 D. HZ+Y-![]() HY+Z-的平衡常数为K=1.0×103
HY+Z-的平衡常数为K=1.0×103
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com