
| 实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL |
| 1 | 20.00 | 11.95 |
| 2 | 20.00 | 13.00 |
| 3 | 20.00 | 12.05 |
| 5 |
| 2 |
| 0.024g |
| 20cm3 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
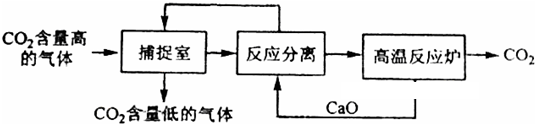
查看答案和解析>>
科目:高中化学 来源: 题型:
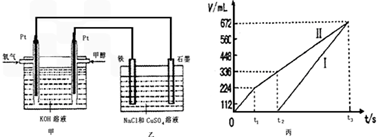
查看答案和解析>>
科目:高中化学 来源: 题型:
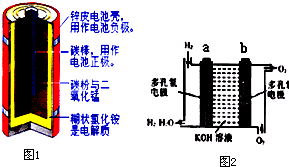
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.| a | |||||||
| b | c | d | |||||
查看答案和解析>>
科目:高中化学 来源: 题型:
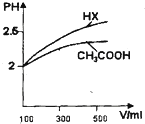 已知25℃时部分弱电解质的电离平衡常数数据如下表
已知25℃时部分弱电解质的电离平衡常数数据如下表| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | Ka1=4.3×10-7、Ka2=5.6×10-11 |
| H2SO3 | Ka1=1.0×10-2、Ka2=1.02×10-7 |
| c(H2SO3) |
| c(HSO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
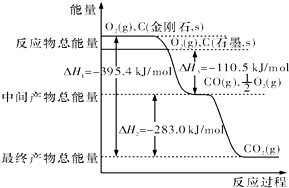
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com