
����Ŀ������Ԫ�ض����γɶ������ʣ����ǿ���������ѧ���ʽṹ�����ʵ����֪ʶȡ��ʶ�����⡣
��1����̬��ԭ�ӵļ۵����Ų�ʽΪ_____������ſڴƻơ��еĴƻƷ���ʽΪAs2S3�����ӽṹ��ͼ ����Asԭ�ӵ��ӻ���ʽΪ_________��
����Asԭ�ӵ��ӻ���ʽΪ_________��
��2��N2��CO�ķ��ӽṹ���ƣ�1��CO�����к��еġǼ���Ŀ��_____����
��3��������ͭ��Һ��ͨ�������NH3�������ɿ����������[Cu(NH3)4]SO4��H2O���塣�þ��������ķǽ���Ԫ���У��縺��������_________����Ԫ�ط��ţ�����һ������������_________����Ԫ�ط��ţ��������Ҵ�������[Cu(NH3)4]SO4��H2O�����ԭ����________��
��4��������PCl5��һ�ְ�ɫ���壬��������ϵ����ṹģ��������ͼ��ʾ����A��B���������ɣ����������148���ۻ����γ�һ���ܵ�������塣��֪A����CCl4������ͬ�ռ乹�ͺͳɼ���ʽ����AΪ_________��BΪ__________��
��5������(BP)��һ�ֳ�Ӳ��ĥͿ����ϣ�����ͼΪ���������������е�ÿ��ԭ�Ӿ�����8�����ȶ��ṹ�����ж����۵�_______________(����ڡ����ڡ�)���ʯ�۵㡣��֪��B-P������Ϊx cm�������ܶ�Ϊ_______________ g�qcm-3(�г�����ʽ����)��

���𰸡� 4s24p3 sp3�ӻ� 2 O N �Ҵ����Ӽ��Ա�ˮ���Ӽ������������Ҵ������ܼ��ļ��ԣ��Ӷ���С���ʵ��ܽ�� PCl4+ PCl4- ���� 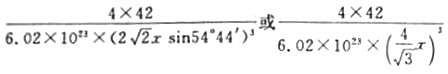
����������1����̬��ԭ�ӵĵ����Ų�ʽΪ[Ar]3d104s24p3������۵����Ų�ʽΪ4s24p3��As�������5�����ӣ��γ�3�����ۼ����ļ����Ӷ���Ϊ3�������1���µ��Ӷԣ�����As���ӻ���ʽΪp3�ӻ�����2��CO�Ľṹ���Ա�ʾΪ![]() ��������Բ���ʾ�Ǽ�����1��CO�����к��еġǼ���Ŀ��2������3�������[Cu(NH3)4]SO4��H2O���������ķǽ���Ԫ����N��H��S��OԪ�أ����зǽ�������ǿ����OԪ�أ���縺��������O��NԪ��ԭ�ӵ�2p���Ϊ���������һ����������Ҵ����Ӽ��Ա�ˮ���Ӽ������������Ҵ������ܼ��ļ��ԣ��Ӷ���С���ʵ��ܽ�ȣ�����[Cu(NH3)4]SO4��H2O���壻��4��A����CCl4������ͬ�ռ乹����Ӧ��ԭ������һ����5��ԭ���Ҽ۵���������ͬΪ32������Ӧ�ô�һ����λ����ɵ�PCl4+���ӣ���BΪ������ɵ�PCl4-���ӣ���5�����ʯ�������嶼��ԭ�Ӿ��壬����ԭ�ӵİ뾶��̼ԭ�Ӵ�C��C���ۼ�������B��PС�����ܴ������������۵�Ҫ�Ƚ��ʯ�ĵͣ� Pλ�ڶ�������ģ����P�ĸ���Ϊ8��1/8��6��1/2=4��Bλ�����ģ���4���������Ļ�ѧʽΪBP����˾���������Ϊ4��42/NAg��B��P�ļ���Ϊx������Խ���Ϊ1/4������Խ���Ϊ4x����˾����ı߳�Ϊ
��������Բ���ʾ�Ǽ�����1��CO�����к��еġǼ���Ŀ��2������3�������[Cu(NH3)4]SO4��H2O���������ķǽ���Ԫ����N��H��S��OԪ�أ����зǽ�������ǿ����OԪ�أ���縺��������O��NԪ��ԭ�ӵ�2p���Ϊ���������һ����������Ҵ����Ӽ��Ա�ˮ���Ӽ������������Ҵ������ܼ��ļ��ԣ��Ӷ���С���ʵ��ܽ�ȣ�����[Cu(NH3)4]SO4��H2O���壻��4��A����CCl4������ͬ�ռ乹����Ӧ��ԭ������һ����5��ԭ���Ҽ۵���������ͬΪ32������Ӧ�ô�һ����λ����ɵ�PCl4+���ӣ���BΪ������ɵ�PCl4-���ӣ���5�����ʯ�������嶼��ԭ�Ӿ��壬����ԭ�ӵİ뾶��̼ԭ�Ӵ�C��C���ۼ�������B��PС�����ܴ������������۵�Ҫ�Ƚ��ʯ�ĵͣ� Pλ�ڶ�������ģ����P�ĸ���Ϊ8��1/8��6��1/2=4��Bλ�����ģ���4���������Ļ�ѧʽΪBP����˾���������Ϊ4��42/NAg��B��P�ļ���Ϊx������Խ���Ϊ1/4������Խ���Ϊ4x����˾����ı߳�Ϊ![]() cm�������ܶȵĶ��壬�������ܶ�Ϊ
cm�������ܶȵĶ��壬�������ܶ�Ϊ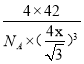 g/cm3��
g/cm3��


 �����ߴ���ϵ�д�
�����ߴ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ�о���ѧϰС��Ϊ��ģ�ҵ���̴�Ũ���ĺ�ˮ����ȡҺ�壬��������֪��Br2�ķе�Ϊ59�棬����ˮ���ж��ԡ���������²������輰��Ҫʵ��װ��(�г�װ����ȥ)��
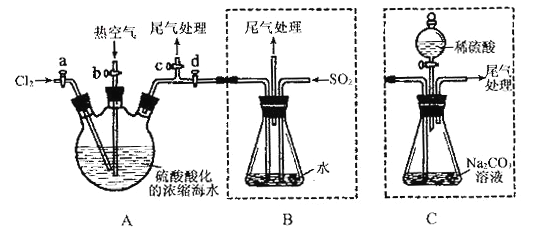
������A��B���رջ���b��d������a��c����A�л���ͨ������Ӧ�������ڹر�a��c����b��d����A�й��������ȿ������۽��в���ڵ�ͬʱ����B��ͨ������SO2 ���ܹر�b����a����ͨ��A��B�л���ͨ������Cl2 ;
�ݽ�B������Һ����������ռ�Һ�塣
��ش�(1)ʵ�����в��ù�Һ�����Ʊ������Ļ�ѧ����ʽΪ______________________��
(2)������й����ȿ���������Ϊ_________________________��
(3)�����B�з�������Ҫ��Ӧ�����ӷ���ʽΪ_____________________��
(4)��ʵ����β������______________(��ѡ����ĸ)���մ�����
a��ˮ b��Ũ���� c��NaOH��Һ d.����NaCl��Һ
(5)������У�����ͼ��ʾװ�ý��������ռ�Һ�壬��װ��ͼ��ȱ�ٵı�Ҫ��������������
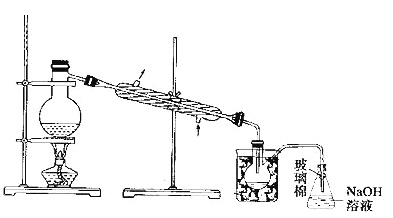
(6)��ֱ������A��C�����в���ٺ͢ڣ���ַ�Ӧ������ƿ�еμ�ϡ���ᣬ�پ�����ݣ�Ҳ���Ƶ�Һ�塣�μ�ϡ����֮ǰ��C�з�Ӧ������NaBrO3�ȣ���д���μ�ϡ����ʱ������Ӧ�����ӷ���ʽ_________________��
(7)��Bװ����ȣ�����Cװ�õ��ŵ�Ϊ_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ��(CH2��CH��CH2OH)�ɷ����Ļ�ѧ��Ӧ��(����)
�ټӳɡ�����������ȼ�ա��ܼӾۡ���ȡ��
A. �٢ڢ�B. �٢ڢۢ�
C. �٢ڢۢܢ�D. �٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1mol/LNaOH��Һ�ζ�40mL0.1mol/LH2SO3��Һ�����õζ���������ͼ��ʾ�����Ի��ʱ��Һ����ı仯����������������ȷ����

A. H2SO3��Ka1=1��10-2
B. 0.05mol/L NaHSO3��Һ��PH=4.25
C. ͼ��Y���Ӧ����Һ�У�3c(SO32-)=c(Na+)+c(H+)-c(OH-)
D. ͼ��Z���Ӧ����Һ�У�c(Na+)> c(SO32-)> c(HSO32-)> c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����е��뷽��ʽ��ˮ�ⷽ��ʽ��ȷ���ǣ� ��
A.H2S2H++S2��
B.NaHSO4�TNa++H++SO42��
C.CO32��+2H2OH2CO3+2OH��
D.Al3++3H2OAl��OH��3��+3H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У���ͨ������¼�����Ũ���������ü�ʯ�Ҹ�����У� ��
A.H2S��O2��N2
B.HCl��Cl2��CO2
C.N2��H2��CO
D.SO2��Cl2��O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ���κ����ζ���������ˮ��.
B. �ڱ���Na2CO3��Һ��ͨ��CO2û���κ�����
C. ��CO2ͨ��CaCl2��Һ�������ͣ��г�������
D. �ó���ʯ��ˮ������Na2CO3��NaHCO3��ĩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ��ȼ��ʱ�����������������������( )
A. ú B. Һ��ʯ���� C. �Ҵ� D. ˮú��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������廯����A����Ҫ���л�����ԭ�ϡ���A�Ʊ��л�������F�ĺϳ�·�������ַ�Ӧ������ȥ����ͼ��ʾ��
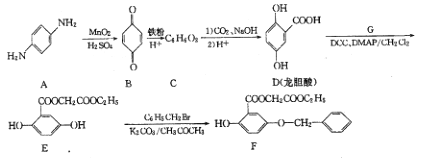
��1��A��ˮ��Һ��_____________������ԡ��������ԡ�����
��2��C�Ľṹ��ʽΪ_____________��
��3��д��E��F��Ӧ�Ļ�ѧ����ʽ_____________��
��4��д����������������������������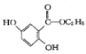 ����һ��ͬ���칹��Ľṹ��ʽ_____________��
����һ��ͬ���칹��Ľṹ��ʽ_____________��
���ܷ���������Ӧ
������FeCl3��Һ������ɫ��Ӧ����ˮ�����֮һ����FeCl3��Һ������ɫ��Ӧ
���˴Ź�������������壬�ҷ����֮��Ϊ6:2:1:1
��5�����������ϳ�·�ߣ����һ�����ȱ����Ҵ�Ϊԭ���Ʊ�ˮ����������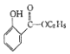 ���ĺϳ�·������ͼ�����Լ��������������Ϣ��
���ĺϳ�·������ͼ�����Լ��������������Ϣ�� ��
��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com