
����Ŀ���״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ش��������⣺
��1��һ���¶��£���һ���ݵ��ܱ������У���CO��H2�ϳɼ״���
CO��g��+2H2��g�� ![]() CH3OH��g��
CH3OH��g��
������������˵���÷�Ӧ�Ѵﵽƽ��״̬����___________������ţ�
A��ÿ����1mol CO��ͬʱ����2molH2
B��������������ʵ�������
C������CH3OH������������CO���������
D��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯
��CO��ƽ��ת���ʣ��������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��B��C�����ƽ�ⳣ��K��C��____K��B�������������=��������
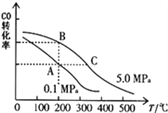
��ij�¶��£���2.0mol CO��6.0molH2����2L���ܱ������У��ﵽƽ��ʱ���c��CO��=0.25mol/L��CO��ת����=______�����¶��µ�ƽ�ⳣ��K=______��������λ��Ч���֣�
��2�������£���V mL��0.20mol/L����������Һ��μ��뵽20.00mL��0.20mol/L������Һ�У���ַ�Ӧ����ҺpH=7����ʱV______20.00�����������=����������������������Һ�������Һǡ����ȫ��Ӧʱ����Һ����������Ũ���ɴ�С����˳��_____________
��3���¶�650���������ȼ�ϵ�أ��ã�CO��H2������Ӧ�������CO2�Ļ������Ϊ������Ӧ������缫����Li2CO3��Na2CO3�����������ʡ��õ�ص�������ӦʽΪ__________��
���𰸡� ABD �� 75% 1.3 �� c(Na+)>c(HCOO-)>c(OH-)>c(H+) O2+4e��+2CO2 = 2CO32��
�����������������(1) �����ݻ�ѧƽ��״̬���������桢���������䡢�����ش��жϣ�C����¶ȴ���B�㣬�����¶�CO��ƽ��ת���ʼ�С��ƽ�������ƶ����� ,����������ʽ������ƽ�ⳣ������2�����������ᣬ����������ǿ�����ǡ����ȫ��Ӧʱ���ɴ����ƣ�������ˮ����Һ�ʼ�������3�������������õ�������̼������ӣ�
,����������ʽ������ƽ�ⳣ������2�����������ᣬ����������ǿ�����ǡ����ȫ��Ӧʱ���ɴ����ƣ�������ˮ����Һ�ʼ�������3�������������õ�������̼������ӣ�
������(1) ��A��ÿ����1mol CO��ͬʱ����2molH2����֤�����淴Ӧ������ȣ����Է�Ӧһ���ﵽƽ��״̬����A��ȷ��B���÷�Ӧ���������ʵ�����С�ķ�Ӧ��������������ʵ���������˵��һ���ﵽƽ��״̬����B��ȷ��C������CH3OH������������CO��������ȣ�����ָ����Ӧ���ʣ����Բ�һ��ƽ�⣬��C����D�����ݻ�ѧƽ��Ķ���CH3OH��CO��H2��Ũ�ȶ����ٷ����仯��һ���ﵽƽ��״̬����D��ȷ����C����¶ȴ���B�㣬�����¶�CO��ƽ��ת���ʼ�С��ƽ�������ƶ�������K��C��<K��B����
��

CO��ת����=![]()
 =
=![]() 1.3 ��
1.3 ��
��2�����������ᣬ����������ǿ�����ǡ����ȫ��Ӧʱ���ɴ����ƣ�������ˮ����Һ�ʼ�����Ҫʹ��Һ�����ԣ�Ӧ��С�������Ƶ���������������������Һ�����V<20.00�������ˮ�⣬��Һ�ʼ��ԣ�������Һ����������Ũ���ɴ�С����˳��c(Na+)>c(HCOO-)>c(OH-)>c(H+)��
��3�������������õ�������̼������ӣ��缫��Ӧ��O2+4e��+2CO2 = 2CO32����


 ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д�
ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͬ����CO(g)��H2O(g)�ֱ�ͨ�����Ϊ2 L�ĺ����ܱ������У����з�Ӧ��CO(g) + H2O(g) ![]() CO2(g) + H2(g)���õ������������ݣ�
CO2(g) + H2(g)���õ������������ݣ�
ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | |
CO | H2O | CO2 | |||
1 | 650 | 4 | 2 | 1.6 | 5 |
2 | 900 | 2 | 1 | 0.4 | 3 |
3 | 2 | 1 | 0.4 | 1 | |
����˵������ȷ����
A. �÷�Ӧ������ӦΪ���ȷ�Ӧ
B. ʵ��1�У�ǰ5min��CO��ʾ������Ϊ0.16 mol/(L��min)
C. ʵ��2�У�ƽ�ⳣ��K=1/6
D. ʵ��3��ʵ��2��ȣ��ı�������������¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͭ�Ǻϳ��������������в�����������ͭ����Ҫǰ����֮һ������������һ��ʵ���Һϳ�·����


�Ʊ��������װ������ͼ��ʾ(���Ⱥͼг�װ�õ���)����֪����������۵�Ϊ76.5 ����������ˮ�������Ҵ����ش��������⣺(1)��250 mL����ƿa�м���70 mL70%���ᡣ���ƴ�����ʱ����������ˮ��Ũ������Ⱥ�˳����_____________________��
(2)��a�е���Һ������100 ���������μ�40 g�����浽������Һ�У�Ȼ��������130 ��������Ӧ����װ���У�����b��������______________������c��������__________����������__________________����Ӧ�������������ˮ���ٷ�����������Ʒ��������ˮ��Ŀ����_______�����������п����ڷ��뱽�����Ʒ����___________(����)��
A����Һ©�� B��©��C���ձ� D��ֱ�������� E��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(SrSO4)��ˮ�еij����ܽ�ƽ���������¡�����˵����ȷ����

A. �¶�һ��ʱ��Ksp(SrSO4)��c(SO42��)���������С
B. ������ͬ�¶��У�313 KʱKsp(SrSO4)���
C. 363 Kʱ��ͼ��a���Ӧ����Һ�Dz�������Һ
D. 283 K�µ�SrSO4������Һ���µ�363 K���Ϊ��������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���25��ʱijЩ�ε�Ũ�Ȼ�����������ĵ���ƽ�ⳣ��������˵����ȷ����
��ѧʽ | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
Ksp��Ka | Ksp=1.8��10-10 | Ksp=2.0��10-12 | Ka=1.8��10-5 | Ka=3.0��10-8 | Ka1=4.1��10-7 Ka2=5.6��10-11 |
A. ��ͬŨ��CH3COONa��NaClO�Ļ��Һ�У�������Ũ�ȵĴ�С��ϵ��c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. ��Ũ�Ⱦ�Ϊl��10-3mol/L��KCl��K2CrO4���Һ�еμ�l��10-3mol/LAgNO3��Һ��CrO42-���γɳ���
C. ̼������Һ�еμ�������ˮ�����ӷ���ʽΪCO32-+Cl2+H2O=HCO3-+Cl-+HClO
D. ��0.1mol/LCH3COOH��Һ�еμ�NaOH��Һ��c(CH3COOH):c(CH3COO-)=5:9����ʱ��ҺpH=5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ҩƷ�DZ�ˮ�����ϳ�·�����£��ش��������⣺

��֪��
��1���DZ�ˮ��ķ���ʽΪ__________�������DZ�ˮ�������˵����ȷ����______(�����)��
A��1 mol�DZ�ˮ������Ժ�2 mol NaOH��Ӧ
B�����ܷ���������Ӧ
C���ɷ���ˮ�ⷴӦ
D�������巢��ȡ����Ӧ
��2��A������Ϊ______________________��
��3�� A��B�����Լ�Ϊ_________________��D��E��Ӧ���л���Ӧ������_____________��
��4��B�� C��Ӧ�Ļ�ѧ����ʽΪ________________________________________________��
��5�� F��ͬ���칹���м�����FeCl3������ɫ��Ӧ�����ܷ���������Ӧ�����ʹ���________�֣�д�����к˴Ź���������ʾ4��壬�ҷ����֮��Ϊ1:2:2:1��ͬ���칹��Ľṹ��ʽ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��֤ͬ����Ԫ�����ʵĵݱ���ɡ�ijС������ͼ��ʾ��װ�ý���ʵ��(�г���������ȥ��װ���������Ѽ���)��

ʵ����̣�
��.���ɼУ�����a���μ�Ũ���ᡣ
��.��װ��B��װ��C�е���Һ����Ϊ��ɫʱ���н����ɼС�
��.��װ��B����Һ�ɻ�ɫ��Ϊ�غ�ɫʱ���رջ���a��
��.����
��1������NaOH��Һ����������____________________________��
��2��װ��A�з������û���Ӧ�Ļ�ѧ����ʽΪ___________________��
��3��װ��B����Һ��NaBr��ȫ��������������Cl2�����ʵ���Ϊ__________��
��4��Ϊ��֤��Ԫ�صķǽ�����ǿ�ڵ�Ԫ�أ����̢��IJ�����������__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���ڶ���ǰ��̽����Ǵ����д��������ʻ���OCS������֪�й�OCS�ķ�Ӧ��CO+S![]() OCS��2OCS+SO2
OCS��2OCS+SO2![]() 2CO2+3S������˵������ȷ���ǣ� ��
2CO2+3S������˵������ȷ���ǣ� ��
A. CO2������ÿ��ԭ������㶼�ﵽ��8�����ȶ��ṹ B. ԭ�Ӱ뾶��S��C��O
C. OCS��CO2�������Ӽ� D. OCS���ڹ��ۻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ӧ�ù㷺�Ľ�����������������Ҫ�ɷ�ΪAl2O3����SiO2��Fe2O3��������Ϊԭ���Ʊ�����һ�ֹ�������������
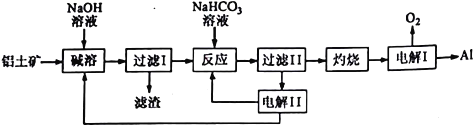
ע��SiO2����������ʱת��Ϊ�������Ƴ�����
��1��A1��ԭ�ӽṹʾ��ͼΪ_______________��A1��NaOH��Һ��Ӧ�����ӷ���ʽΪ______________________________________��
��2�� ��������ʱ����ƫ�����Ƶ����ӷ���ʽΪ_______________________________��
��3������ ������������Һ�м���NaHCO3��Һ����Һ��pH_________���������������� ������������С������
��4�� ��������ǵ������Al2O3������������������ʯī�����ģ�ԭ����__________________��
��5���������ԭ����ͼ��ʾ��
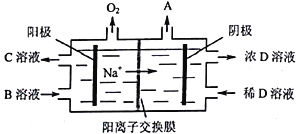
����д��A��B��C��D���ʵĻ�ѧʽ��A_______��B_______��C_______��D_______��
�������ĵ缫��ӦʽΪ______________________________��
��6��������1000��ʱ����N2��Ӧ�Ʊ�AlN������������������NH4Cl���岢��ֻ�ϣ�������AlN���Ʊ�������Ҫԭ����________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com