
【题目】将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g),得到如下三组数据:
CO2(g) + H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
CO | H2O | CO2 | |||
1 | 650 | 4 | 2 | 1.6 | 5 |
2 | 900 | 2 | 1 | 0.4 | 3 |
3 | 2 | 1 | 0.4 | 1 | |
下列说法不正确的是
A. 该反应的正反应为放热反应
B. 实验1中,前5min用CO表示的速率为0.16 mol/(L·min)
C. 实验2中,平衡常数K=1/6
D. 实验3跟实验2相比,改变的条件可能是温度
【答案】D
【解析】A. 由表中数据可知,实验1中CO的转化率为40%,而实验2中CO的转化率为20%,压强不能使该化学平衡发生移动,由于温度升高使得CO的转化率减小,所以该反应的正反应为放热反应,A正确;B. 实验1中,前5min用CO表示的速率为![]() 0.16 mol/(L·min),B正确;C. 实验2中,平衡混合物中各组分CO、H2O、CO2、H2的浓度分别为0.8mol/L、0.3 mol/L、0.2 mol/L、0.2 mol/L,所以平衡常数K=
0.16 mol/(L·min),B正确;C. 实验2中,平衡混合物中各组分CO、H2O、CO2、H2的浓度分别为0.8mol/L、0.3 mol/L、0.2 mol/L、0.2 mol/L,所以平衡常数K=![]() 1/6,C正确;D. 实验3跟实验2相比,各组分的平衡量没有改变,所以改变的条件不可能是温度,可能是加入了合适的催化剂,D不正确。本题选D。
1/6,C正确;D. 实验3跟实验2相比,各组分的平衡量没有改变,所以改变的条件不可能是温度,可能是加入了合适的催化剂,D不正确。本题选D。


科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. NO2通入水中:3NO2+H2O=2H++2NO2-+NO
B. Fe(OH)3溶于HI溶液:Fe(OH)3+3H+=Fe3++3H2O
C. (NH4)2SO4溶液中加入Ba(OH)2溶液:NH4++SO42-+Ba2++OH-=BaSO4↓+NH3·H2O
D. 向NaAlO2溶液中滴入NaHCO3溶液产生白色沉淀:AlO2-+HCO3-+H2O=Al(OH)3↓+CO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
①C(s) + H2O(g)=CO(g) + H2(g) ΔH1 = a kJmol-1
②CO(g) + H2O(g)=CO2 (g) + H2 (g) ΔH2 = b kJmol-1
③CO2(g) + 3H2(g)=CH3OH(g) + H2O(g) ΔH3= c kJmol-1
④2CH3OH(g)=CH3OCH3(g) + H2O(g) ΔH4= d kJmol-1
A. 反应①、②为反应③提供原料气
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)![]() 1/2 CH3OCH3 (g) +1/2H2O(l)的ΔH=d/2kJ·mol1
1/2 CH3OCH3 (g) +1/2H2O(l)的ΔH=d/2kJ·mol1
D. 反应 2CO(g) + 4H2 (g)![]() CH3OCH3 (g) + H2O(g)的ΔH= ( 2b+ 2c+d)
CH3OCH3 (g) + H2O(g)的ΔH= ( 2b+ 2c+d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物柴油是一种用植物油、动物油或废弃油脂等为原料加工而成的清洁燃料,主要成分为高级脂肪酸甲酯。一种用菜籽油等为原料制备生物柴油的实验步骤如下:
①向右图所示的三口烧瓶中加入3.2 g CH3OH、0.2 g NaOH,溶解后向其中加入20 g(0.021~0.023 mol)菜籽油及60 mL正己烷。


②加热至60~65 ℃,搅拌2.5~3 h,静置。上层为生物柴油、正己烷及甲醇,下层主要为甘油。
③分液、水洗。
④蒸馏,保持120℃时至无液体流出,剩余物为生物柴油。
(1)步骤①中控制n(CH3OH)/n(油脂)>3的目的是________;正己烷的作用是________。
(2)步骤②适宜的加热方式是________;菜籽油的成分之一油酸甘油酯(结构简式如右图)与甲醇反应的化学方程式为________________________________________________。
(3)步骤③用分液漏斗分离时,获取上层液体的方法是________;用水洗涤上层液体时,说明已洗涤干净的依据是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应:2NO2(g) =2NO(g)+O2(g) (正反应吸热)。实验测得:v正= v(NO2)消耗= k正c2(NO2) v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法不正确的是
容器 编号 | 物质的平衡浓度(mol/L) | 物质的起始浓度(mol/L) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A. 温度为T1,反应达平衡时,容器Ⅲ中的平衡常数K=0.8
B. 达平衡时,速率常数和化学平衡常数的关系K= k正/k逆
C. 当温度改变为T2时,若k正=k逆则T21
D. 容器Ⅱ反应达平衡前,v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门实验科学,化学反应过程中的能量变化和速率变化是中学化学研究的重要内容
Ⅰ.利用如图所示装置测定中和热
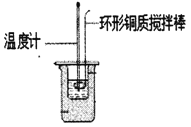
(1)图中明显有一处错误,请指出___________
(2)________(填“能”或“不能”)用Ba(OH)2 溶液和硫酸代替氢氧化钠溶液和盐酸进行中和热测定
Ⅱ.探究硫酸铜的量对氢气生成速率的影响。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积气体所需的时间。
实验 混合溶液 | A | B | C | D | E | F |
4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
(1) 请完成此实验设计,其中: V8=_________
(2) 当CuSO4溶液少量时,反应速率明显加快,原因_______
(3) 当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3可用于生产硝酸和尿素。
(1)生产硝酸:
① NH3催化氧化是工业制硝酸的第一步反应,其化学方程式是_____。
② 除此之外,还可能发生以下副反应:
4NH3 (g)+ 4O2 (g) === 2N2O (g) +6H2O (g) ΔH=-1105 kJ/mol
4NH3 (g) + 3O2 (g) === 2N2 (g) +6H2 O(g) ΔH=-1269 kJ/mol
两个副反应在理论上趋势均很大,但实际生产中影响并不大,原因是_____。
(2)生产尿素:
① 尿素的合成分两步进行:
a.2NH3 (g)+CO2(g) ![]() NH2COONH4(l) ΔH=-117 kJ/mol
NH2COONH4(l) ΔH=-117 kJ/mol
b.NH2COONH4(l) ![]() CO(NH2)2(l)+H2O(l) ΔH=+15 kJ/mol
CO(NH2)2(l)+H2O(l) ΔH=+15 kJ/mol

写出总反应的热化学方程式:______。
② 右图为n(NH3):n(CO2) = 4 : 1时,温度对CO2的转化率的影响。解释温度升高CO2的平衡转化率增大的原因:______。
③ 测定尿素样品含氮量的方法如下:取a g尿素样品,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L1 NaOH溶液恰好中和,则尿素样品中氮元素的质量分数是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
(1)一定温度下,在一恒容的密闭容器中,由CO和H2合成甲醇:
CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
①下列情形能说明该反应已达到平衡状态的是___________(填序号)
A.每消耗1mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
②CO的平衡转化率(α)与温度、压强的关系如图所示。B、C两点的平衡常数K(C)____K(B)(填“>”、“=”或“<”)
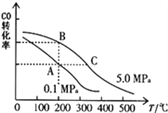
③某温度下,将2.0mol CO和6.0molH2充入2L的密闭容器中,达到平衡时测得c(CO)=0.25mol/L,CO的转化率=______,此温度下的平衡常数K=______(保留二位有效数字)
(2)常温下,将V mL、0.20mol/L氢氧化钠溶液逐滴加入到20.00mL、0.20mol/L甲酸溶液中,充分反应,溶液pH=7,此时V______20.00(填“>”、“=”或“<”);当氢氧化钠溶液与甲酸溶液恰好完全反应时,溶液中所含离子浓度由大到小排列顺序_____________
(3)温度650℃的熔融盐燃料电池,用(CO、H2)作反应物,空气与CO2的混合气体为正极反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。该电池的正极反应式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com