
【题目】下列关于物质的量浓度表述错误的是
A. 将6.2 g氧化钠溶于水配成1L溶液,其中溶质的物质的量浓度为0.2mol·L-1
B. 将1 L0.2 mol·L-1 Ca(NO3)2溶液稀释到10 L时,NO![]() 的浓度为0.04 mol·L-1
的浓度为0.04 mol·L-1
C. 用1L水吸收标准状况下的22.4L氨气所得氨水中,c(NH3·H2O)=1mol·L-1
D. 5 mL2 mol·L-1 NaCl溶液和10 mL 0.5 mol·L-1 MgCl2溶液中,n(Cl-)相等
【答案】C
【解析】A. 6.2 g氧化钠溶于水生成0.2molNaOH,故溶质为NaOH,物质的量的浓度为0.2mol·L-1,A正确;B. Ca(NO3)2为强电解质,溶液中NO3-的物质的量为0.4mol,当溶液体积为10L时,NO3-的物质的量的浓度为0.04 mol·L-1,B正确;C.水与氨气反应生成 NH3·H2O,为可逆反应,不能完全反应,所以水中NH3·H2O的物质的量<1mol,故c(NH3·H2O) <1mol·L-1,C错误;D. NaCl与MgCl2均为强电解质,能完全电解,NaCl溶液中n(Cl-)=0.005×2=0.01mol,
MgCl2溶液中n(Cl-)=0.01×0.5×2=0.01mol,故两种溶液中n(Cl-)相等,D正确。故选择C。


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】酸、碱、盐均属于电解质,它们的水溶液中存在各种平衡。
(1)氨水是中学常见碱
①下列事实可证明氨水是弱碱的是________(填字母序号)。
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
B.常温下,0.1mol/L氨水pH为11
C.铵盐受热易分解
D.常温下,0 1mol/L氯化铵溶液的pH为5
②下列方法中,可以使氨水电离程度增大的是______(填学母序号)。
A.通入氨气 B.如入少量氯化铁固体
C.加水稀释 D.加入少量氯化铵固体
(2)25℃,在0.1mol/L H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,密液pH与c(S2-
关系如下图(忽略溶液体积的变化、H2S的挥发)。
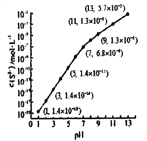
①pH=13 时,溶液中的c(H2S)+c(HS-)=______mol/L。
②某溶液含0.020mol/LMn2+、0.10mol/LH2S,当溶液pH=____时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3)聚合硫酸铁(PFS) 是水处理中重要的絮凝剂。盐基度B是衡量絮凝剂紫凝效果的重要指标,定义式为B=3n(OH-)/n(Fg3+)(n为物质的量)。为测量样品的B值。取样品mg,准确加入过量盐酸,充分反应,再加入点沸后冷却的蒸馏水,以酚酞为指示剂,用cmol/L的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液VmL。按照上述步骤做空白对照试验,消耗NaOH溶液V0mL已知该样品中Fe的质量分数w,则B 的表达式为_________。
(4)常温时,若Ca(OH)2和CaWO4 (钨酸钙) 的沉淀溶解平衡曲线如图所示(已知: ![]() =0.58)。
=0.58)。
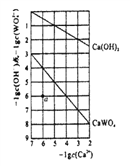
①a点表示Ca(OH)2和CaWO4________(填“是”或“否”)达到溶解平衡,说 明理由_______________。
②饱和Ca(OH)2溶液和饱和CaWO4溶液等体积混合,写出混合溶液中各离了浓度大小关系__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A. 28g乙烯和丙烯中的极性键数目为4NA
B. 32gCu和32gS充分反应,转移电子数为NA
C. 1L0.3mol·L-1Na2CO3溶液中的阴离子数目小于0.3NA
D. 0.2molNH3与0.3molO2在催化剂的作用下充分反应,所得NO的分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有质量分数为98%的浓硫酸,密度为1.84 g·cm-3。现要配制0.5mol/L的稀硫酸450 mL,试回答下列问题:
(1)该浓硫酸的物质的量浓度为_________。配制稀硫酸时,应选用规格为______mL的容量瓶,经计算需要__________mL浓硫酸。
(2)在量取浓硫酸后,进行了下列操作,其正确顺序是________________(填序号)。
a. 待稀释硫酸的温度与室温一致后,沿玻璃棒注入容量瓶中。
b. 往容量瓶中小心加蒸馏水至液面离刻度线1~2cm时,改用胶头滴管加蒸馏水,使溶液的凹液面与刻度标线相切。
c. 用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液全部注入容量瓶。
d. 将浓硫酸慢慢注入盛蒸馏水的烧杯中,边倒边用玻璃棒搅动,使其混合均匀。
e. 将容量瓶盖紧,反复上下颠倒,摇匀。
(3)下列操作会导致所配硫酸浓度偏低的是______。
A.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
B.用量筒量取浓硫酸时,俯视读数
C.定容时仰视容量瓶刻度线
D.定容摇匀后有少量溶液外流
E. 定容摇匀后,发现液面下降,继续加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池、电解池的叙述中正确的是
A. 发生氧化反应的电极分别为负极和阴极
B. 阴离子分别向负极和阴极迁移
C. 电子流向分别由负极直接流向正极、阴极直接流向阳极
D. 若都有一个电极质量减轻,应分别为负极和阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作的解释或结论正确的是
选项 | 实验操作 | 解释或结论 |
A | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
B | 用蒸馏水润湿的pH试纸测溶液pH | 一定会使测定结果偏低 |
C | 向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp: Mg(OH)2 >Fe(OH)3 |
D | 用氢氧化钾与浓硫酸测定中和反应的反应热 | 测得的结果偏小 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1molL﹣1的CH3COOH溶液滴定20mL 0.1molL﹣1的NaOH溶液,当滴加VmLCH3COOH溶液时,混合溶液的pH=7.已知CH3COOH的电离平衡常数为Ka,忽略混合时溶液体积的变化,下列关系式正确是( )
A.Ka=![]() B.V=
B.V=![]()
C.Ka=![]() D.Ka=
D.Ka=![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com