
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A. 28g乙烯和丙烯中的极性键数目为4NA
B. 32gCu和32gS充分反应,转移电子数为NA
C. 1L0.3mol·L-1Na2CO3溶液中的阴离子数目小于0.3NA
D. 0.2molNH3与0.3molO2在催化剂的作用下充分反应,所得NO的分子数为0.2NA
【答案】A
【解析】A.乙烯和丙烯的最简式为CH2,28gCH2的物质的量为2mol,而2molCH2中含4mol极性键,所以28g乙烯和丙烯中的极性键数目为4NA,A正确;B. Cu和S反应生成Cu2S,Cu不足,转移电子数为0.5NA,B错误;C.CO32-水解生成HCO3-和OH-,导致阴离子数目增多,因此1L0.3mol·L-1Na2CO3溶液中的阴离子数目大于0.3NA,C错误;D.依据4NH3+5O2![]() 4NO+6H2O,0.2molNH3与0.3molO2在催化剂的作用下加热充分反应,氧气剩余,则生成的一氧化氮部分与氧气反应生成二氧化氮,所以最终生成一氧化氮分子数小于0.2NA,D错误;答案选A.
4NO+6H2O,0.2molNH3与0.3molO2在催化剂的作用下加热充分反应,氧气剩余,则生成的一氧化氮部分与氧气反应生成二氧化氮,所以最终生成一氧化氮分子数小于0.2NA,D错误;答案选A.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 水的离子积常数KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
B. Ksp个仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
C. 温温下,CH3COOH的Ka=1.7×10-5,NH3·H2O的Kb=1.7×10-5,CH3COOH溶液液中的c(H+)与NH3·H2O溶液的c(OH-)相等
D. 常温下、在0.1moL的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH4+)/(NH3·H2O)的值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学变化的叙述错误的是
A. 化学变化一定伴随能量变化
B. 化学变化一定有化学键的断裂和生成
C. 化学变化一定伴随物质的状态变化
D. 化学变化一定有新物质生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Fe 2 (SO 4 ) 3 和Al 2 (SO 4 ) 3 的混合溶液中,逐滴加入NaOH溶液至过量。下列图象中,能正确表示上述反应的是
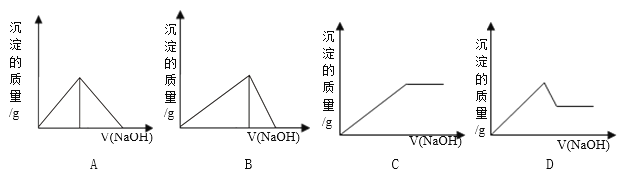
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物M(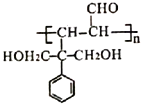 )和高分子化合物J用途广泛。其合成路线如下图所示:
)和高分子化合物J用途广泛。其合成路线如下图所示:
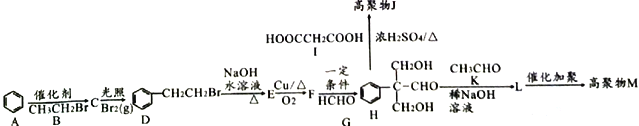
已知:①![]()
②CH3CHO+HCHO![]() HOH2C-CH2-CHO
HOH2C-CH2-CHO
③CH3CHO+HCHO![]() CH2=CH-CHO+H2O
CH2=CH-CHO+H2O
回答下列问题:
(1)有机物C的名称是___________________。
(2)D到E和E到F的反应类型分别是__________________、______________________。
(3)有机物L的结构简式为______________________。
(4)控制反应条件保证H中醛基不被氧化,H与I发生缩聚反应得到高聚物J的化学方程式为___________________________________________。
(5)有机物F的催化氧化产物满足下列条件的同分异构体有_______种;其中核磁共振氢谱有4组峰的结构简式为____________________;
①含有苯环 ②能够发生银镜反应 ③与FeCl3溶液不发生显色反应
(6)根据本题的条件设计用![]() 、CH3Cl、CH3CH2CHO合成
、CH3Cl、CH3CH2CHO合成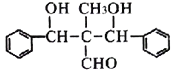 的路线。___________________
的路线。___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们分别位于三个周期。Y和M同主族,火山喷口附近或地壳的岩层中存在游离态的M,X元素的最高价氧化物对应的水化物与其气态氢化物相遇会有白烟。这五种元素组成一种离子化合物Q,取一定量Q溶于蒸馏水得到溶液,向此溶液中滴加稀氢氧化钠溶液,产生沉淀的物质的量与氢氧化钠溶液体积的关系如图所示。下列说法不正确的是( )
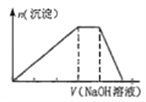
A. 简单氢化物的沸点:Y>X
B. 简单离子的半径:M>Y>Z
C. R与除Z以外的其他3种元素均能形成共价化合物
D. Y与其他4种元素均可形成至少两种二元化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级四氧化三铁是应用最为广泛的软磁性材料之一。共沉淀法是目前制备纳米四氧化三铁的重要方法,其流程如图示:
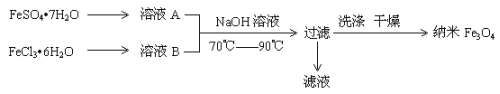
下列说法不正确的是
A.保存溶液A时,应加入少量铁粉
B.其制备反应类型不属于氧化还原反应
C.取滤液进行焰色反应,火焰为黄色
D.FeSO4·7H2O 和 FeCl3·6H2O的物质的量之比最好应为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量浓度表述错误的是
A. 将6.2 g氧化钠溶于水配成1L溶液,其中溶质的物质的量浓度为0.2mol·L-1
B. 将1 L0.2 mol·L-1 Ca(NO3)2溶液稀释到10 L时,NO![]() 的浓度为0.04 mol·L-1
的浓度为0.04 mol·L-1
C. 用1L水吸收标准状况下的22.4L氨气所得氨水中,c(NH3·H2O)=1mol·L-1
D. 5 mL2 mol·L-1 NaCl溶液和10 mL 0.5 mol·L-1 MgCl2溶液中,n(Cl-)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应有:
反应 | △H(kJ/mol) | K |
i. Fe2O3(s)+3C(s) | +489 | K1 |
ii. Fe2O3(s)+3CO(g) | X | k2 |
iii. C(s)+CO2(g) | +172 | k3 |
试计算,X=____,K1、K2与K3之间的关系为__________________。
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应i,反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图1所示,则t1时刻改变的条件可能是_______(填写字母)。
a.保持温度不变,压缩容器 b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉 d.保持温度体积不变,增大CO浓度
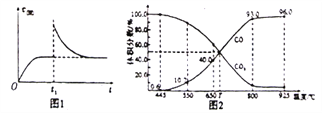
(3)在一定温度下,向某体积可变的恒压密闭容器(P总)加入1molCO2与足最的碳,发生反应iii,平衡时体系中气体体积分数与温度的关系如图2所示。
①650℃时,该反应达平衡后吸收的热量是__________。(计算时不考虑温度对△H的影响)
②T℃时,若向平衡体系中再充入一定量按v(CO2):V(CO)=5:4的混合气体,平衡______(填“正向”、”逆向”或“不”)移动。
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp为_____。[气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压化替物质的量浓度也可以表示化学平衡常数,记作Kp]
(4)用原电池原理可以除去酸性废水中的三氯乙烯、AsO3-,其原理如图3所示(导电壳内部为纳米零价铁)。
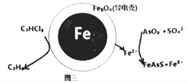
在除污过程中,纳米零价铁中的Fe为原电池的____极(填“正”或“负”),写出C2HCl3在其表面被还原为乙烷的电极反应式为____________________。
(5)NaHS可用于污水处理的沉淀剂。已知:25℃时,反应Hg2+(aq)+HS-(aq) ![]() HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
①NaHS的电子式为____________________。
②Ksp(HgS)=_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com