
【题目】铁在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应有:
反应 | △H(kJ/mol) | K |
i. Fe2O3(s)+3C(s) | +489 | K1 |
ii. Fe2O3(s)+3CO(g) | X | k2 |
iii. C(s)+CO2(g) | +172 | k3 |
试计算,X=____,K1、K2与K3之间的关系为__________________。
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应i,反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图1所示,则t1时刻改变的条件可能是_______(填写字母)。
a.保持温度不变,压缩容器 b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉 d.保持温度体积不变,增大CO浓度
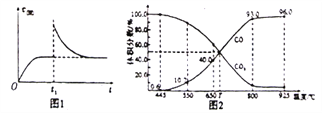
(3)在一定温度下,向某体积可变的恒压密闭容器(P总)加入1molCO2与足最的碳,发生反应iii,平衡时体系中气体体积分数与温度的关系如图2所示。
①650℃时,该反应达平衡后吸收的热量是__________。(计算时不考虑温度对△H的影响)
②T℃时,若向平衡体系中再充入一定量按v(CO2):V(CO)=5:4的混合气体,平衡______(填“正向”、”逆向”或“不”)移动。
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp为_____。[气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压化替物质的量浓度也可以表示化学平衡常数,记作Kp]
(4)用原电池原理可以除去酸性废水中的三氯乙烯、AsO3-,其原理如图3所示(导电壳内部为纳米零价铁)。
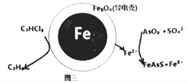
在除污过程中,纳米零价铁中的Fe为原电池的____极(填“正”或“负”),写出C2HCl3在其表面被还原为乙烷的电极反应式为____________________。
(5)NaHS可用于污水处理的沉淀剂。已知:25℃时,反应Hg2+(aq)+HS-(aq) ![]() HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。
①NaHS的电子式为____________________。
②Ksp(HgS)=_______________。
【答案】 -27 K3=(K1/K2)1/3 ad 43kJ 正向 23.04p总 负 C2HCl3 +5H++8e-=C2H6 +3Cl- ![]() 4.0×10-53
4.0×10-53
【解析】(1) 已知i. Fe2O3(s)+3C(s)![]() 2Fe(s)+3CO(g) △H=+489 kJ/mol,
2Fe(s)+3CO(g) △H=+489 kJ/mol,
iii. C(s)+CO2(g)![]() 2CO(g) △H=+172 kJ/mol,
2CO(g) △H=+172 kJ/mol,
根据盖斯定律可知,i- iii![]() 3得Fe2O3(s)+3CO(g)
3得Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H=-27 kJ/mol
2Fe(s)+3CO2(g) △H=-27 kJ/mol
由上述过程可知:![]() =K2,即K3=(K1/K2)1/3 ,因此,本题正确答案为:-27 ;K3=(K1/K2)1/3
=K2,即K3=(K1/K2)1/3 ,因此,本题正确答案为:-27 ;K3=(K1/K2)1/3
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应i,反应达到平衡后,在t1时刻,改变某条件,V(逆)突然增大,但重新达到平衡状态后与原平衡相同,说明温度不变,平衡常数K=c3(CO)不变,则t1时刻改变的条件压缩容器的体积或增大CO的浓度,故答案为:ad。
(3) ①由图2可知,650℃时,该反应达平衡后,CO的体积分数为40%,根据化学平衡“三行式”有: C(s)+CO2(g)![]() 2CO(g)
2CO(g)
起始(mol) 1 0
转化(mol) x 2x
平衡(mol) 1-x 2x
则![]() 100%=40%,解得:x=0.25mol。
100%=40%,解得:x=0.25mol。
由反应:C(s)+CO2(g)![]() 2CO(g) △H=+172 kJ/mol可知该反应达平衡后吸收的热量是:
2CO(g) △H=+172 kJ/mol可知该反应达平衡后吸收的热量是:
0.25mol![]() 172kJ/mol=43 kJ,故答案为43kJ
172kJ/mol=43 kJ,故答案为43kJ
②T℃时,若向平衡体系中再充入一定量按v(CO2):V(CO)=5:4的混合气体,因原平衡时v(CO2):V(CO)=1:1,由于5:4>1:1,故平衡正向移动,因此答案为:正向。
③925℃时,CO的体积分数为96%,则CO2的体积分数为4%,所以用平衡分压代替平衡浓度表示的化学平衡常数Kp=![]() =23.04p总,故答案为23.04p总。
=23.04p总,故答案为23.04p总。
(4)由如图3可知纳米零价铁中的Fe失去电子作负极,C2HCl3在其表面被还原为乙烷,根据电荷守恒和原子守恒,该电极反应式为C2HCl3 +5H++8e-=C2H6 +3Cl-。故答案为:负 ;C2HCl3 +5H++8e-=C2H6 +3Cl-。
(5)①NaHS为含有共价键的离子化合物,其电子式为:![]()
②由已知:I.Hg2+(aq)+HS-(aq) ![]() HgS(s)+H+(aq) K=1.75×1038,
HgS(s)+H+(aq) K=1.75×1038,
II.HS-![]() H++S2- Ka2=7.0×10-15,
H++S2- Ka2=7.0×10-15,
II-I得:HgS(s)![]() =4.0×10-53,因此,本题答案为:
=4.0×10-53,因此,本题答案为:![]() ;4.0×10-53。
;4.0×10-53。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A. 28g乙烯和丙烯中的极性键数目为4NA
B. 32gCu和32gS充分反应,转移电子数为NA
C. 1L0.3mol·L-1Na2CO3溶液中的阴离子数目小于0.3NA
D. 0.2molNH3与0.3molO2在催化剂的作用下充分反应,所得NO的分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池、电解池的叙述中正确的是
A. 发生氧化反应的电极分别为负极和阴极
B. 阴离子分别向负极和阴极迁移
C. 电子流向分别由负极直接流向正极、阴极直接流向阳极
D. 若都有一个电极质量减轻,应分别为负极和阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作的解释或结论正确的是
选项 | 实验操作 | 解释或结论 |
A | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
B | 用蒸馏水润湿的pH试纸测溶液pH | 一定会使测定结果偏低 |
C | 向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp: Mg(OH)2 >Fe(OH)3 |
D | 用氢氧化钾与浓硫酸测定中和反应的反应热 | 测得的结果偏小 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】索氏提取法是测定动植物样品中粗脂肪含量的标准方法。其原理是利用如图装置,用无水乙醚等有机溶剂连续、反复、多次萃取动植物样品中的粗脂肪。具体步骤如下:

①包装:取滤纸制成滤纸筒,放入烘箱中干燥后,移至仪器X中冷却至室温。然后放入称量瓶中称量,质量记作a;在滤纸筒中包入一定质量研细的样品,放入烘箱中干燥后,移至仪器X中冷却至室温,然后放入称量瓶中称量,质量记作b。
②萃取:将装有样品的滤纸筒用长镊子放入抽提筒中,注入一定量的无水乙醚,使滤纸筒完全浸没入乙醚中,接通冷凝水,加热并调节温度,使冷凝下滴的无水乙醚呈连珠状,至抽提筒中的无水乙醚用滤纸点滴检查无油迹为止(大约6h~12h)。
③称量:萃取完毕后,用长镊子取出滤纸筒,在通风处使无水乙醚挥发,待无水乙醚挥发后,将滤纸筒放入烘箱中干燥后,移至仪器X中冷却至室温,然后放入称量瓶中称量,质量记作c。
回答下列问题:
(1)实验中使用了三次的仪器X的名称___________。为提高乙醚蒸气的冷凝效果,索氏提取器可选用下列______(填字母)代替。
a. 空气冷凝管![]() b.直形冷凝管
b.直形冷凝管![]()
C.蛇形冷凝管![]()
(2)①实验中必须十分注意乙醚的安全使用,如不能用明火加热、室内保持通风等。为防止乙醚挥发到空气中形成燃爆,常在冷凝管上口连接一个球形干燥管,其中装入的药品为___(填字母)。
a.活性炭 b.碱石灰 c:P2O5 d.浓硫酸
②无水乙醚在空气中可能氧化生成少量过氧化物,加热时发生爆炸。检验无水乙醚中是否含有过氧化物的方法是______________________。
(3)①实验中需控制温度在70℃~80℃之间,考虑到安全等因素,应采取的加热方式是_____。
②当无水乙醚加热沸腾后,蒸气通过导气管上升,被冷凝为液体滴入抽提筒中,当液面超过回流管最高处时,萃取液即回流入提取器(烧瓶)中……该过程连续、反复、多次进行,则萃取液回流入提取器(烧瓶)的物理现象为________。
A.冷凝回流 B.虹吸 C.倒吸 D.分液
③索氏提取法与一般萃取法相比较,其优点为_______________。
(4)数据处理: 样品中纯脂肪百分含量_______(填“<”、“>”或“=”)![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚对苯二甲酸乙二醇酯(PET)俗称涤纶树脂,是一种重要的有机高分子材料。其结构为 。利用有机物A合成PET的路线如下图所示:
。利用有机物A合成PET的路线如下图所示:

已知:①![]() ;②
;② 。
。
根据题意回答下列问题:
(1)A的名称是_______,C所含官能团的名称是_______。
(2)由1,3-丁二烯可制备顺式聚1,3-丁二烯,写出顺式聚l,3-丁二烯的结构简式_______。
(3)A→D、B→C的反应类型分别为_______ 、_______。
(4)写出C+F→PET的化学反应方程式______________。
(5)G是F的同系物,其相对分子质量比F多28,G的核磁共振氢谱有三组峰,峰面积比为3:1:1,则符合该条件的G的同分异构体共有_____种。
(6)参照上述合成路线,以1,3-丁二烯为原料(无机试剂任选),设计制备丁苯橡胶( )的合成路线_______________。
)的合成路线_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1molL﹣1的CH3COOH溶液滴定20mL 0.1molL﹣1的NaOH溶液,当滴加VmLCH3COOH溶液时,混合溶液的pH=7.已知CH3COOH的电离平衡常数为Ka,忽略混合时溶液体积的变化,下列关系式正确是( )
A.Ka=![]() B.V=
B.V=![]()
C.Ka=![]() D.Ka=
D.Ka=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产、生活中有着重要应用。
(1)氯胺[NH2Cl(g)]是一种长效缓释含氯消毒剂,有缓慢而持久的杀菌作用,试写出其杀菌过程中与水反应的化学方程式________________。
(2)羟胺(NH2OH)是有机合成的常见还原剂。工业上可用硝酸.硫酸水溶液作电解质进行电解,在汞电极上NO3-可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式为________________。
(3)银氨溶液是检验醛基的重要试剂,其溶液中存在Ag(NH3)2+(aq)![]() Ag+(aq)+2NH3(aq)。常温下,反应AgCl(s)+2NH3(aq)
Ag+(aq)+2NH3(aq)。常温下,反应AgCl(s)+2NH3(aq)![]() Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=1.94×10-3,且Ksp(AgCl)=1.76×10-10,则K[Ag(NH3)2+]=________________。
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=1.94×10-3,且Ksp(AgCl)=1.76×10-10,则K[Ag(NH3)2+]=________________。
(4)水合肼(N2H4·H2O)常用作锅炉水的除氧剂。N2H4·H2O为二元弱碱,在水溶液中的一级电离方程式表示为N2H4·H2O![]() N2H5++OH-。盐酸肼(N2H6Cl2)是一种可溶性盐,其第一步水解的离子方程式为________________,溶液中离子浓度由大到小的排列顺序为________________。
N2H5++OH-。盐酸肼(N2H6Cl2)是一种可溶性盐,其第一步水解的离子方程式为________________,溶液中离子浓度由大到小的排列顺序为________________。
(5)氨是一种重要的氮肥。工业合成氨反应为:![]() N2(g)+
N2(g)+ ![]() H2(g)
H2(g)![]() NH3(g),该反应的活化能Ea1=254kJ/mol。
NH3(g),该反应的活化能Ea1=254kJ/mol。
①查阅文献,相关化学键键能数据如下:
化学键 | H-H | N | N-H |
E/kJ·mol-1 | 436 | 946 | 391 |
则反应NH3(g)![]()
![]() N2(g)+
N2(g)+ ![]() H2(g)的活化能Ea2=________________。
H2(g)的活化能Ea2=________________。
②一定条件下,1molN2与3.6molH2在密闭容器中充分反应,测得放出的热量为13.8kJ,则H2的转化率为________________,为提高原料的利用率,工业合成氨应该采取的措施是=________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com