
【题目】丙烷的分子结构可简写成键线式结构![]() ,有机物A的键线式结构为
,有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A.有机物A的一氯取代物只有4种
B.用系统命名法命名有机物A,名称为2,2,3三甲基戊烷
C.有机物A的分子式为C8H18
D.B的结构可能有3种,其中一种名称为3,4,4三甲基2戊烯
科目:高中化学 来源: 题型:
【题目】根据下列化合物:①NaOH,②H2SO4,③CH3COOH,④NaCl,⑤CH3COONa,⑥NH4Cl,⑦CH3COONH4,⑧NH4HSO4,⑨NH3H2O,请回答下列问题:
(1)NH4Cl溶液中离子浓度大小顺序为_____________。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH﹣)=_________;在pH=3的CH3COOH溶液中,水电离出来的c(H+)=___________。
(3)已知水存在如下平衡:H2O+H2O![]() H3O++OH﹣△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是_________。
H3O++OH﹣△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是_________。
A.向水中加入NaHSO4固体 B.向水中加NaHCO3固体
C.加热至100℃[其中c(H+)=1×10﹣6mol/L] D.向水中加入NH4Cl固体
(4)在常温下,NH3H2O的电离常数为1.810-5,若浓度均为0.1mol/L、等体积的NaOH和NH3H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则 m_________n(填“<”、“>”或“=”)。
(5)物质的量浓度相同的⑥、⑦、⑧、⑨四种稀溶液中,NH4+浓度由大到小的顺序是(填序号)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3个体积均为1 L的恒容密闭容器中发生反应:SO2(g)+2NO(g)![]() 2NO2(g)+S(s)。改变容器I的反应温度,平衡时c(NO2)与温度的关系如图所示。下列说法正确的是( )
2NO2(g)+S(s)。改变容器I的反应温度,平衡时c(NO2)与温度的关系如图所示。下列说法正确的是( )
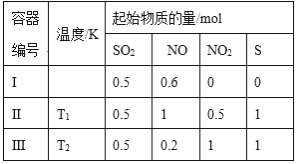
A.该反应的ΔH>0
B.T1时,该反应的平衡常数为![]()
C.容器Ⅰ与容器Ⅱ均在T1时达到平衡,总压强之比大于1:2
D.若T2<T1,达到平衡时,容器Ⅲ中NO的体积分数大于40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应mA(g)+nB(g) ![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)若加入B(容器体积不变),则A的转化率______(填增大、减小或不变,下同),B的转化率______。
(2)若升高温度,则平衡时B、C的浓度之比c(B)/c(C)将______(填增大、减小或不变)。
(3)若B是有色物质,A、C均无色,则加入C(容积不变)时混合物颜色________(填变深、变浅或不变,下同),而维持容器内压强不变,充入Ne时,混合物的颜色_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种烷烃和一种烯烃组成的混合气体共10 g,混合气体的密度是相同状况下氢气密度的12.5倍,该混合气体通过Br2水时,Br2水的质量增加8.4 g,则组成该混合气体的可能是( )
A.甲烷、乙烯B.丙烷、乙烯C.乙烷、丙烯D.甲烷、丙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置;Ⅳ、Ⅴ、Ⅵ是气体收集装置,根据要求回答下列问题:



![]()


(1)若用MnO2与浓盐酸反应制取氯气,应选用装置________,用方程式表示的制取氯气的反应原理是___________________________。
(2)若用KMnO4与浓盐酸反应制取氯气,应选用的装置________,
试完成并配平下列离子方程式:___MnO4-+____Cl-+____H+![]() ___Mn2++___Cl2↑+_____。
___Mn2++___Cl2↑+_____。
(3)若选用Ⅳ为氯气的收集装置,应该在试管口放置一团棉花,该棉花团应用________溶液浸湿,其作用是________。
(4)若选用Ⅴ为氯气收集装置,则氯气应从________口通入.用化学方法检验氯气收集满了的方法是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气态烃A中碳元素与氢元素的质量比为6︰1.淀粉在一定条件下水解可生成B。B在人体组织中缓慢氧化,放出热量,提供生命活动所需能量。有关物质的转化关系如下图:
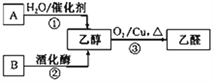
请回答:
(1)①的反应类型是_________________。
(2)向试管中加入2 mL10%氢氧化钠溶液,滴加4~5滴5%硫酸铜溶液,振荡后加入2 mL10% B溶液,加热。写出加热后观察到的现象_____________________________。
(3)反应③的化学方程式是__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)等体积等物质的量浓度的盐酸和氨水溶液混合后,溶液呈_____(填“酸性”,“中性”或“碱性”),溶液中c(H+)_____ c(OH—)+c(NH3·H2O)(填“>”或“=”或“<”)。
(2)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH—)=_______mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中c(OH-)=__________mol/L,由水电离产生的c(H+)=_______mol/L,此时温度_______25℃(填“高于”、“低于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiCl2是化工合成中最重要的镍源。工业上利用含镍(Ni)废催化剂(主要含有Ni,还含有SiO2、Al2O3、Fe及其它不溶于酸、碱的杂质)生产氯化镍晶体(NiCl2·nH2O)流程如下:
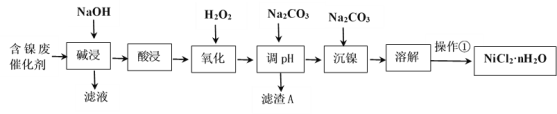
部分金属氢氧化物Ksp近似值如下表所示:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-38 | 10-34 | 10-15 |
回答下列问题:
(1)Ni的原子序数为28,位于元素周期表第四周期,最外层电子数为2,则其原子结构示意图为________________。
(2)“酸浸”、“溶解”所使用的酸为_____________。“碱浸”时发生反应的离子方程式为SiO2+2OH-=SiO32-+H2O、___________________。
(3)“氧化”加入H2O2溶液,其作用是____________________(用离子方程式表示)。然后调节pH使溶液中铁元素恰好完全沉淀(离子浓度≤10-5mol·L-1时,离子沉淀完全),此时常温下的pH约为____________。
(4)“操作①”的实验操作依次为缓缓加热,浓缩至_________________________为止、冷却结晶、过滤、洗涤、干燥,即得产品。
(5)为了测定NiCl2nH2O中结晶水数目进行如下实验:取23.8 g样品在一定条件下脱水得13.0 g NiCl2,则n=__________。
(6)镍氢电池已成为混合动力汽车的主要电池类型,其在碱性电解质溶液的工作原理如下:M+Ni(OH)2![]() MH+NiOOH(式中M为储氢合金)。写出电池充电过程中阳极的电极反应式__________________。
MH+NiOOH(式中M为储氢合金)。写出电池充电过程中阳极的电极反应式__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com