
����Ŀ����ѧ����ʵ��Ϊ�����Ŀ�ѧ������ʵ���Ǹ�һѧ���������յĻ���ʵ�飬�����ʵ����������������⣻
��1����ͼ�ǴӺ�������ȡ�ⵥ�ʵĹ��̣�
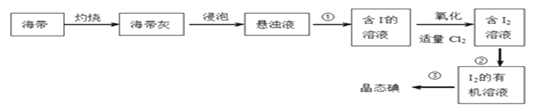
�ٽ���ʵ��ٵIJ��������ǣ�_________________��
���ڽ���ʵ��ڵĹ����У�����ѡ����л��ܼ���____________��
A���Ҵ� B�����Ȼ�̼ C���� D. ����
�۴�I2���л���Һ����ȡ���װ����ͼ��ʾ������a������Ϊ��_______��
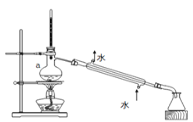
����I-����Һ�м�����������������Ӧ�����ӷ���ʽΪ��__________________________��
��2����ͼ��ʵ������ȡ����������ʵ��װ�ã��ش��������⣺
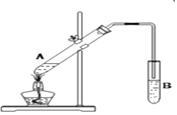
����A�Թ��м����Լ���˳����___________ ����������ĸ��ţ���
a����Ũ�������Ҵ������� b����Ũ������������Ҵ� c�����Ҵ���Ũ���������
�����Թ�B�г�����_______________ ����������������
���𰸡����� BC ������ƿ Cl2 +2I-��2Cl-+I2 C ����̼���ƣ���Һ��
��������
��1�����������ͼ��֪���������յõ������ң�������������ˮ�õ�����Һ������Һ���˵õ��������ӵ���Һ�������ӵ���Һ��ͨ����������������������ӷ����û���Ӧ���ɵⵥ�ʵõ����ⵥ�ʵ���Һ��Ȼ���ⵥ�ʵ���Һ�����л��ܼ���ȡ������ȡ��Һ�õ������ʵ���л���Һ������������õ����ʵ⡣
��2�����ʵ��װ��Ϊ��ȡ����������ʵ��װ�ã�װ��A����Ũ���������£��Ҵ������Ṳ�ȷ���������Ӧ��������������ˮ��װ��B��ʢ�е��DZ���̼������Һ��Ŀ�����кͻӷ����������ᣬʹ֮ת��Ϊ����������ˮ�У�������������������ζ���ܽ�ӷ��������Ҵ�����������������ˮ�е��ܽ�ȣ����ڷֲ�õ�����
��1����ʵ���Ϊ����������Һ���˵õ��������ӵ���Һ���ʴ�Ϊ�����ˣ�
��ʵ���Ϊ�ⵥ�ʵ���Һ����������ˮ���ҵ���ܽ�Ƚϴ���л��ܼ���ȡ�����Ȼ�̼����ȡ��Һ�õ������ʵ���л���Һ���ʴ�Ϊ��BC��
�۴�I2���л���Һ����ȡ���װ��Ϊ����װ�ã���ͼ��֪������aΪ������ƿ���ʴ�Ϊ��������ƿ��
����I-����Һ�м�����������������������ӷ����û���Ӧ���ɵⵥ�ʵõ����ⵥ�ʵ���Һ����Ӧ�����ӷ���ʽΪCl2 +2I-��2Cl-+I2���ʴ�Ϊ��Cl2 +2I-��2Cl-+I2��
��2����Ũ������ܶȱ��Ҵ�����A�Թ��м����Լ���˳�������ڴ��Թ��м����Ҵ���Ȼ������������ע�����ᣬ�����Ͻ��裬�����װ���Ҵ���Ũ����Ļ����Ĵ��Թ��м������ᣬ�ʴ�Ϊ��C��
�����Թ�B�г����뱥��̼������Һ��Ŀ�����кͻӷ����������ᣬʹ֮ת��Ϊ����������ˮ�У�������������������ζ���ܽ�ӷ��������Ҵ�����������������ˮ�е��ܽ�ȣ����ڷֲ�õ������ʴ�Ϊ������̼������Һ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣��������е���ĸ�ֱ����ijһԪ�ء�
B | C | D | |||||
A | E | F | |||||
��1��A�ĵ�����������Ӧˮ����ĵ���ʽΪ__________��
��2��R���ɱ����ѱ����A~F ��ij����Ԫ����ɵĻ�����dz�����������������Ҫ�ɷ֣��仯ѧ����Ϊ_____________��Na2FeO4�ǹ�ҵ���õ�������������R �Ʊ�Na2FeO4��ԭ�����£��벹��ȱ�ٵ����ʣ�����ƽ��Ӧ����ʽ��ϵ����___ Fe(OH)3 + ___R��________�� + ___ NaOH = ____ Na2FeO4 + ___ NaCl + ____H2O
��3����̬�⻯��е㣺D _____ E��Ԫ���γɵļ����ӵİ뾶��A _____ D���>������<����=����
��4��E ��ij��������ͨ��F ���ʵ�ˮ��Һ�У�����������F ����ˮ��Һ��Ư���ԣ����Ϸ���ʽ˵��______________________________________________________________��
��5���ɱ���δ�����ij�ֽ���Ԫ�صĵ���G �����Է�����ͼ��ʾ��ת����
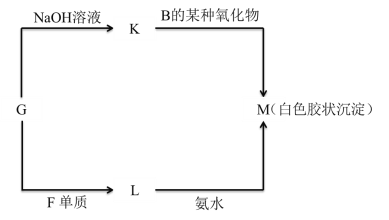
��д�� G ת��Ϊ K �Ļ�ѧ����ʽ________________________________________��
��д�� L ת��Ϊ M �����ӷ���ʽ________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ���Ȼ���������ýȾ�����л��ϳ��е��Ȼ�������ʵ���ҿ������ڵ���(�۵�232��)��Cl2��Ӧ�Ʊ�SnCl4��װ����ͼ��
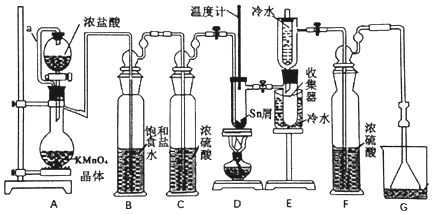
��֪:��SnCl2��SnCl4�й���������:
���� | ��ɫ��״̬ | �۵�/�� | �е�/�� |
SnCl2 | ��ɫ���� | 246 | 652 |
SnCl4 | ��ɫҺ�� | ��33 | 114 |
��SnCl4����ˮ������SnO2H2O��
�ش���������:
��1������a��������____________________________________________________________��װ��A�з�����Ӧ�����ӷ���ʽΪ________________________________________��
��2�����۲쵽װ��FҺ���Ϸ�______________ʱ�ſ�ʼ��ȼD���ľƾ��ƣ������ۻ����ʵ����������������������ȡ���ʱ�������ȵ�Ŀ����____________________________��
��3��������װ����ȱ��װ��C(��������ͬ)����D����֧�Թ��з�������Ҫ����Ӧ��ѧ����ʽΪ____________________________________________________________��
��4��Cl2�����ķ�Ӧ������SnCl4��SnCl2��Ϊ��ֹ��Ʒ�д�������SnCl2���ɲ�ȡ�Ĵ�ʩ��____________________________________________________________��
��5���ζ�������Ʒ��2��Sn(II)�ĺ���:�÷�����ƽ��ȡ5.000 g��Ʒ����ƿ�У�������ˮ�ܽ⣬���������Һ����0.1000 molL��1�ĵ����Һ�ζ����յ�ʱ����20.00 mL�����Ʒ��Sn(II)�ĺ���Ϊ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������½������г���0.8molSO2, 0.2molO2, 0.6molSO3���Ϊ2L���ܱ������У�������Ӧ��2SO2 (g)+ O2 (g)2SO3(g),�ﵽ��ѧ��Ӧ��ʱ��SO3���ʵ��������ǣ��� ��mol
A. 0B. 0.3C. 1.0D. 1.5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ժ����ʵ���۽��Ͳ���ȷ���ǣ� ��
A.ʪ�·������������ĵط������ɨD�D�¶����ߣ������˶��ӿ�
B.����⣨I2���͵�������I2������ʹ������Һ�����D�Dͬ�ַ��ӻ�ѧ������ͬ
C.Һ̬ˮ��Ϊˮ�����D�D����������
D.���������ȷֽ����ɹ��������D�D��ѧ��Ӧ�з��ӷ����ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D��E�������ڱ���ǰ�����ڵ�Ԫ�أ����ǵĺ˵�����������ࡣ����A��B��C�����ܲ���Ϊ2�ķǽ���Ԫ�ء�������DCΪ���ӻ����D�Ķ�����������C�������Ӿ�����ͬ�ĵ��Ӳ�ṹ��AC2Ϊ�Ǽ��Է��ӡ�E�ĺ�������Ų�����6��δ�ɶԵ��ӣ���ͬ���������ģ�ECl3����B��C���⻯���γ��������������������������ʵ���֮��Ϊ2��1������������λ����硣������Ӧ��Ԫ�ط��Ż�ʽ����գ�
��1��д��Ԫ�ص����� A ___________ E ____________��
��2��A��B��C�ĵ�һ��������С�����˳��Ϊ __________��B���⻯����ӵĿռ乹��Ϊ _________ ��
��3��������AC2��һ����B��C��ɵĻ�����X��Ϊ�ȵ����壬��X�Ļ�ѧʽΪ ____________����ȫ��B��ԭ����ɵ�ij������AC2Ҳ���ڵȵ����壬�����ӵĻ�ѧʽΪ _____ ����ռ乹��Ϊ __________ ��
��4��ECl3�γɵ������Ļ�ѧʽΪ ____________________________ ��
��5��D�ĵ�����AC2�п���ȼ�ղ�һ�ְ�ɫ�����һ�ֺ�ɫ���壬�÷�Ӧ�Ļ�ѧ����ʽΪ ________ ��
��6����Eͬ���ڣ������������Ų���ͬ��Ԫ����___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Һ�����(��AG��ʾ)����Ϊc(H+)�� C(OH-)��ֵ�Ķ�������AG=lg![]() �������£����и���������AG��12����ɫ��Һ���ܴ���������ǣ�������
�������£����и���������AG��12����ɫ��Һ���ܴ���������ǣ�������
A. Mg2+��Ca2+��HCO3-��Cl-
B. K+��I-��SO42-��Br-
C. MnO4����Ca2+��Cl-��NO3��
D. Na+��Al(OH)4����Cl-��SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�Ȼ�ѧ����ʽ��SO2(g)+ 1/2O2(g) ![]() SO3(g) ��H���D98.32kJ��mol���������г���2molSO2��1molO2��ַ�Ӧ�����շų�������Ϊ�� ��
SO3(g) ��H���D98.32kJ��mol���������г���2molSO2��1molO2��ַ�Ӧ�����շų�������Ϊ�� ��
A. 196.64kJB. ��98.32kJ
C. ��196.64kJD. ����196.64kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ѿ�298K��101kPaʱ������˵������ȷ����
��Ӧ1��4Fe(s)+3O2(g) = 2Fe2O3 (s) ��H1 ����1648 kJ/mol
��Ӧ2��C(s) + O2 (g) = CO2 (g) ��H2 = ��393 kJ/mol
��Ӧ3��2Fe(s)+2C(s) +3O2(g) = 2FeCO3(s) ��H3 ����1480 kJ/mol
��Ӧ4��2FeCO3(s) +1/2O2(g) =2CO2(g) +Fe2O3(s) ��H4
A. ������Ӧ1.2.3.4������ѧ���Է����ƶ��ܴ�
B. ��Ӧ1��3�ڽϵ��¶������Է���Ӧ����Ӧ4��������Ӧ
C. �Է���Ӧ������Ӧһ���ܷ����������жϹ��̵ķ�������ȷ�����̷���������
D. ��Ӧ1��ʾ����������ȼ�յ��Ȼ�ѧ����ʽ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com