
【题目】实验室用下图所示装置制备干燥纯净的氯气,并进行氯气的性质实验,请回答下列问题:
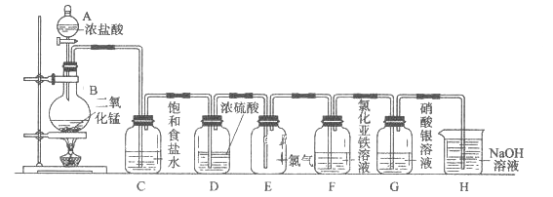
(1)A中盛有浓盐酸,B中盛有MnO![]() ,则烧瓶中发生反应的化学方程式为:______。
,则烧瓶中发生反应的化学方程式为:______。
(2)C中盛有饱和食盐水,其作用是_________,装置D的作用_________。
(3)装置E中气体的颜色为_______,E中Cl![]() 能使湿润的红色布条褪色的原因是________。
能使湿润的红色布条褪色的原因是________。
(4)F中是FeCl![]() 溶液,现象是________,发生反应的离子方程式为__________。
溶液,现象是________,发生反应的离子方程式为__________。
(5)G中是AgNO![]() 溶液,现象是___________,有关化学反应的离子方程式为_________。
溶液,现象是___________,有关化学反应的离子方程式为_________。
(6)H中盛有NaOH溶液,其作用是_______,发生反应的化学方程式为_________。
【答案】MnO2+4HCl(浓)![]() MnCl2 +Cl2↑+2H2O 除去HCl气体杂质 干燥氯气 黄绿色 Cl2与H2O反应生成HClO,HClO具有漂白性使红色布条退色 浅绿色溶液变黄色 2Fe2++Cl2=2Fe3++2Cl- 有白色沉淀生成 Ag++Cl-=AgCl↓ 吸收多余的氯气,防止污染环境 Cl2+2NaOH=NaCl+NaClO+H2O
MnCl2 +Cl2↑+2H2O 除去HCl气体杂质 干燥氯气 黄绿色 Cl2与H2O反应生成HClO,HClO具有漂白性使红色布条退色 浅绿色溶液变黄色 2Fe2++Cl2=2Fe3++2Cl- 有白色沉淀生成 Ag++Cl-=AgCl↓ 吸收多余的氯气,防止污染环境 Cl2+2NaOH=NaCl+NaClO+H2O
【解析】
由图可知,分液漏斗A中浓盐酸与烧瓶中二氧化锰混合,共热反应生成氯气,C中盛有饱和食盐水的作用是除去氯气中混有的挥发出的HCl气体,装置D中盛有的浓硫酸用于干燥氯气,装置E用于收集干燥的氯气,装置F中氯化亚铁溶液被氯气氧化生成氯化铁溶液,溶液颜色发生变化,装置G中硝酸银溶液与氯气反应生成氯化银白色沉淀,装置H中氢氧化钠溶液吸收多余的氯气,防止污染环境。
(1)浓盐酸具有还原性,二氧化锰具有氧化性,浓盐酸和二氧化锰共热发生氧化还原反应生成氯化锰、氯气和水,反应化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)制得的氯气中混有的挥发出的HCl气体和水蒸气,因氯气溶于水,氯化氢极易溶于水,装置C中盛有饱和食盐水降低氯气的溶解度,除去HCl气体杂质;浓硫酸有吸水性,装置D中浓硫酸可以干燥氯气,制得纯净的氯气,故答案为:除去HCl气体杂质;干燥氯气;
(3)Cl2为有刺激性气味的黄绿色气体;干燥的氯气没有漂白性,不能使干燥的有色布条褪色,氯气和水反应生成的次氯酸具有强氧化性,次氯酸能使湿润的有色布条漂白褪色,故答案为:黄绿色;Cl2与H2O反应生成HClO,HClO具有漂白性使红色布条退色;
(4)Cl2具有强氧化性,能将浅绿色的氯化亚铁溶液被氯气氧化生成棕黄色的氯化铁溶液,反应的化学方程式为2FeCl2+Cl2=2FeCl3,故答案为:溶液从浅绿色变为棕黄色;2FeCl2+Cl2
=2FeCl3;
(5)装置G中盛有的是AgNO3溶液,氯气和水反应生成盐酸和次氯酸,氯离子和银离子反应生成白色难溶于水的氯化银,故答案为:有白色沉淀生成;Cl-+Ag+=AgCl↓;
(6)氯气有毒,直接排空会污染环境,氯气能和氢氧化钠反应生成氯化钠、次氯酸钠和水,所以可用氢氧化钠溶液吸收多余的氯气,防止污染环境,反应化学方程式为Cl2+2NaOH=
NaCl+NaClO+H2O,故答案为:吸收多余的氯气;2NaOH+Cl2=NaCl+NaClO+H2O。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 氯化铁溶液与碘化钾溶液反应:Fe3++2I-===Fe2++I2
B. 硫酸溶液与氢氧化钡溶液反应:Ba2++SO42- ===BaSO4↓
C. 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+===Ca2++H2O+CO2↑
D. 氯化铝溶液与过量氨水反应:Al3++3NH3·H2O===Al(OH)3↓+3NH4+
【答案】D
【解析】A. 氯化铁溶液中的铁离子具有氧化性,能够氧化碘离子,与碘化钾溶液反应的离子方程式为2Fe3++2I-===2Fe2++I2,故A错误;B. 硫酸溶液与氢氧化钡溶液反应生成硫酸钡沉淀和水,离子方程式为Ba2++SO![]() +2H++2OH-=2H2O+BaSO4↓,故B错误;C. 醋酸是弱酸,用化学式表示,故C错误;D. 氯化铝溶液与过量氨水反应生成氢氧化铝沉淀,过量的氨水不能溶解氢氧化铝,离子方程式为:Al3++3NH3·H2O===Al(OH)3↓+3NH
+2H++2OH-=2H2O+BaSO4↓,故B错误;C. 醋酸是弱酸,用化学式表示,故C错误;D. 氯化铝溶液与过量氨水反应生成氢氧化铝沉淀,过量的氨水不能溶解氢氧化铝,离子方程式为:Al3++3NH3·H2O===Al(OH)3↓+3NH![]() ,故D正确;故选D。
,故D正确;故选D。
【题型】单选题
【结束】
12
【题目】一定条件下密闭容器中发生如下反应:N2(g)+3H2(g)![]() 2NH3(g),能说明该反应达到化学平衡状态的是( )
2NH3(g),能说明该反应达到化学平衡状态的是( )
A. N2、H2、NH3的浓度相等 B. N2、H2、NH3的浓度不再变化
C. N2、H2、NH3在密闭容器中共存 D. 反应停止,正、逆反应速率都等于零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于核外电子排布的说法中不正确的是( )
A. 第n电子层最多可容纳的电子数为2n2
B. 次外层中最多可容纳的电子数为18
C. 最多可容纳2个电子的电子层一定是第一电子层
D. 最多可容纳8个电子的电子层一定是第二电子层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,在周期表中位置如图,Y原子的最外层电子数是其次外层电子数的3倍。下列说法正确的是( )
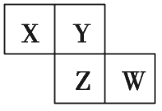
A. X、Y、Z的原子半径大小:X>Y>Z
B. Y、Z的气态氢化物中,前者更稳定
C. Z、W的最高价氧化物对应水化物的酸性,前者更强
D. X、W的气态氢化物相互反应,生成物中只含离子键不含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中以粗铜粉(含杂质Fe)为原料,制备铜的氯化物的流程如下:

请按要求回答下列问题:
(1)现用如图所示的实验仪器和药品来制备纯净、干燥的Cl2并与粗铜粉反应(铁架台和加热装置等省略)。

①按气流方向连接各仪器接口,正确的顺序是a→________→________→________→________→________→________→________。_______实验中硬质玻璃管加热前要进行一步重要操作,该操作是________________________________________________________。
②操作②的方法是________________________________。
(2)上述流程中,所得固体Ⅰ需要加稀盐酸溶解,其目的是________________________;
溶液Ⅰ可加试剂X用于调节pH以除去杂质,X最好选用下列试剂中的________(填字母)。
a.Cu b.NH3·H2O
c.CuO d.Cu2(OH)2CO3
e.H2S
(3)向溶液Ⅱ中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀,写出该反应的离子方程式:____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.05 mol某金属单质与足量的盐酸反应,放出1.68LH2(标准状况),并转变为具有Ne原子的电子层结构的离子,该金属元素在元素周期表中的位置是( )
A. 第三周期第IA族B. 第三周期第ⅢA族
C. 第三周期第ⅡA族D. 第四周期第IA族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com