
����Ŀ��[��ѧ-ѡ��3�����ʽṹ������]
��������һ�ִ��Բ��ϣ����й㷺��Ӧ�á� -
(1)��̬��ԭ�ӵĺ�������Ų�ʽΪ[Ar]_______��
(2)��ҵ�Ʊ������峣ʹ��ˮ�ⷨ���Ʊ�ʱ����������[CO(NH2)2 ]�������Ƶȼ������ʡ����ط��������ֲ�ͬԪ�صĵ縺���ɴ���С��˳����____________����������̼ԭ�ӵ��ӻ�������_________��
(3)��ҵ�Ʊ�������Ҳ��ʹ�ó��������Ʊ�ʱ�����백��NH3)������(N2H4)������Ƚ��±��а�(NH3)������(N2H4)���۷е㣬������ߵ͵���Ҫԭ��________��
N2H4 | NH3 | |
�۵�/�� | 2 | -77.8 |
�е�/�� | 113.5 | -33.5 |
(4)��ͼ�Ǵ����������Ӿ���Fe3O4�У�ȡ�����������侧��ṹ��һ�������壬�����е��������Ƿ��������������ܶѻ�______(��ǡ��������������Dz���Fe3O4�ľ���______(��ǡ����������������������Ӵ���������Χ�ɵ�_____��϶(��ռ�ṹ����
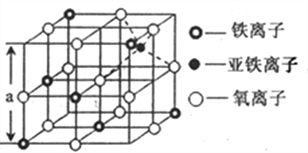
(5)����Fe3O4�����ܵ����ԭ��________��������ͼ����Fe3O4������ܶ�_____gcm-3�� (ͼ��a=0.42nm��������������λ��Ч���֣�
���𰸡� 3d64s2 O>N>C>H sp3�ӻ���sp2�ӻ� ��Ҫԭ�����������Ӽ��γɵ������Ŀ���ڰ����Ӽ��γɵ���� �� �� �������� ���ӿ������ֲ�ͬ��̬�������Ӽ���ٷ���ת�� 5.2g/cm3
��������(1)���ĺ����������Ϊ26�����̬��ԭ�ӵĺ�������Ų�ʽΪ[Ar]3d64s2 ��
(2)����[CO(NH2)2 ]��������Ԫ�طֱ�ΪN��H��C��O��Ԫ�صķǽ�����Խǿ���縺��Խ��������Ԫ�صĵ縺���ɴ���С��˳���ǣ�CH3COONa�м��е�Cԭ�� sp�ӻ����Ȼ��е�Cԭ�� sp�ӻ���
(3)�����������Ӽ��������������������Ӽ��γɵ������Ŀ���ڰ����Ӽ��γɵ�������������ķе����Ը��ڰ���
(4)��ͼʾ��֪�����е������ӹ��������������ܶѻ���������������������ĿΪ12��![]() +1=4��Fe3+����ĿΪ4��
+1=4��Fe3+����ĿΪ4��![]() +3��
+3��![]() =2��Fe2+����ĿΪ1����Fe��O��ԭ����ĿΪ3:4����Fe3O4�ľ�������������������������Χ��6��������Χ�ɵ����������϶���ġ�
=2��Fe2+����ĿΪ1����Fe��O��ԭ����ĿΪ3:4����Fe3O4�ľ�������������������������Χ��6��������Χ�ɵ����������϶���ġ�
(5)�����е��ӿ������ֲ�ͬ��̬�������Ӽ���ٷ���ת�ƣ���Fe3O4�����ܵ��磻��������Ϊa3=��0.42��10-7cm��3��ÿĦ������������Ϊ��56��3+16��4��g=232g����Fe3O4������ܶ�=232g��[NA����0.42��10-7cm��3]=5.2g/cm3��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з��뷽���в���ȷ������ ��
A��������ȡ���������Ȼ�̼��ȡ��ˮ�е��嵥��
B����������ķ������Է���е����ϴ��Һ������
C�����÷�Һ�ķ�������ƾ���ˮ
D�����ýᾧ�ķ�����ȥKNO3�е��Ȼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н��������Ĵ�ʩ�У�ʹ����ӵ�������������������(��)
A. ˮ�еĸ�բ�����ӵ�Դ�ĸ��� B. ������������Ϳ��
C. ��ˮ������Ϳ�߷���Ĥ D. ���¸ֹ�����þ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʼ��ת��ͨ��������Ӧ����ʵ�ֵ���
A��CO2��Na2CO3 B��FeCl3��FeCl2
C��H2SiO3��Na2SiO3 D��S��SO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£������ܱ������н��еķ�Ӧ��2SO2(g) + O2(g) ![]() 2SO3(g)������˵���ܳ��˵���÷�Ӧ�Ѵﵽ��ѧƽ��״̬����
2SO3(g)������˵���ܳ��˵���÷�Ӧ�Ѵﵽ��ѧƽ��״̬����
A. �����淴Ӧ���ʶ������� B. SO2��O2��SO3��Ũ�����
C. SO2��O2��SO3�������й��� D. SO2��O2��SO3��Ũ�Ⱦ����ٱ仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ʵ�����ɳ�����չ����Ҫ��������FeS2��ȼ�ղ�����SO2ͨ�����е�ѭ�����չ��̼�����H2SO4��������H2��

��ش��������⣺
��1����֪1gFeS2��ȫȼ�շų�7.1kJ������FeS2ȼ�շ�Ӧ���Ȼ�ѧ����ʽΪ______________��
��2����ѭ�����չ��̵��ܷ�Ӧ����ʽΪ_____________��
��3���û�ѧƽ���ƶ���ԭ����������HI�ֽⷴӦ��ʹ��Ĥ��Ӧ�������H2��Ŀ����____________��
��4��������H2���ϡ������Ͻ���Ϊ��ظ������ϣ���MH����ʾ����NiO��OH����Ϊ����������ϣ�KOH��Һ��Ϊ�������Һ�����Ƶø��������������������ء���س�ŵ�ʱ���ܷ�ӦΪ��

����طŵ�ʱ�������ĵ缫��ӦʽΪ____________��
��������ʱ��Ni��OH��2ȫ��ת��ΪNiO��OH������������罫��һ���缫����O2��O2��ɢ����һ���缫�����缫��Ӧ�����ģ��Ӷ�������������������ر�ը����ʱ�������ĵ缫��ӦʽΪ______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��5 mL 0.1 mol /L�� H2SO4��15 ml 0.1 mol/L��NaOH��Һ���ϣ���ϡ����500 ml�����������Һ��pHΪ( )
A��12.3 B��11 C��3 D��1.7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������йطǽ���Ԫ�������Լ������������ȷ����( )
�ٷǽ�����F��Cl���ʽ�F2ͨ��NaCl��Һ�У�������ӦΪF2��2Cl��===Cl2��2F��
�ڷǽ�����F��Br�������ԣ�HF��HBr
�۷ǽ�����S��As����ǰ�ߵ���̬�⻯���ȶ��Ը�ǿ
�ܷǽ�����O��N����O2��H2���ϱ�N2������
A���ڢ� B���ۢ�
C���٢� D���٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ�����ڱ���һ���֣�����Ԫ�آ١����ڱ��е�λ�ã����û�ѧ����ش��������⣺
���� | ��A | 0 | ||||||
1 | �� | ��A | ��A | ��A | ��A | ��A | ��A | |
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | �� |
(1)�ܡ��ݡ�������Ԫ���У����Ӱ뾶��С��˳��Ϊ__>__>__�������ӷ��ţ���
(2)�ڡ��ߡ������ۺ�����������ǿ������˳����(�ѧʽ)___>__>__��
(3)������ݵ�����������ˮ���ﷴӦ�����ӷ���ʽΪ________________��
(4)��˵����ķǽ����ԱȢ�ķǽ�����________���ǿ��������������ʵ�ǣ� _________________�������ӷ���ʽ˵������
(5)�ٺ͢��γɵ�18���ӵĻ��������һ��Ӧ�ù㷺�Ļ���ԭ�ϣ�д���ĵ���ʽ___________��ʵ�����п��ô���������Һ�백��Ӧ�Ʊ��ף���Ӧ�Ļ�ѧ����ʽΪ___________________�������ڴ�����ѹ��¯ˮ�е�������ֹ��¯����ʴ��������1kg�ļɳ�ȥˮ���ܽ��O2________kg��
(6)�����£��ɢ٢����10���ӵĻ������ҿ���Ϊȼ�ϵ�ص�ԭ��֮һ����д�����ڼ��Խ����еĵ缫��Ӧʽ��������____________________������_______________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com