
【题目】下列分离方法中不正确的是( )
A.利用萃取方法用四氯化碳提取溴水中的溴单质
B.利用蒸馏的方法可以分离沸点相差较大的液体混合物
C.利用分液的方法分离酒精和水
D.利用结晶的方法除去KNO3中的氯化钠
科目:高中化学 来源: 题型:
【题目】联合国气候变化大会于2009年12月7~18日在哥本哈根召开。中国政府承诺到2020年,单位GDP二氧化碳排放比2005年下降40%~45%。
(1)有效“减碳”的手段之一是节能,下列制氢方法最符合这一做法的是_________(填序号)。
A.电解水制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O![]() CO+3H2
CO+3H2
(2)用CO2和氢气合成CH3OCH3(甲 醚 )是解决能源危机的研究方向之一。
已知:CO(g)+2H2(g)= CH3OH(g) △H = Q1kJ·mol-1
2CH3OH(g)= CH3OCH3(g)+H2O(g) △H = Q2kJ·mol-1
CO(g)+H2O(g)= CO2(g)+H2(g) △H = Q3kJ·mol-1
则CO2和氢气合成CH3OCH3(g)的热化学方程式为:____________________。
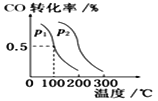
(3)在催化剂和一定温度、压强条件下,CO与H2可反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:p1__________p2 (填“>”、“<”或“ = ”, 下同),该反应的△H__________0 。
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:p1__________p2 (填“>”、“<”或“ = ”, 下同),该反应的△H__________0 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯二氢硅(SiH2Cl2)常用于外延法工艺中重要的硅源。易燃、有毒,与水接触易水解,沸点8.2℃。在铜催化作用下,HCl与硅在25O-260℃反应可以制得SiH2Cl2。

(1)利用浓硫酸、浓盐酸为原料,选用A装置制取HCl,利用了浓硫酸的_____性。
(2)D装置中生成二氯二氢硅的化学方程式为____________。
(3)按照气体从左到右方向,制取SiH2Cl2的装置(h 处用止水夹夹好)连接次序为____________a→ ( ) → ( )→ ( )→ ( )→ ( )→ ( )→ ( )(填仪器接口的字母,其中装置C用到2次)。
(4)按从左到右的顺序,前面装置C中装的药品为________,后面装置C的作用为________。
(5)反应除生成二氯二氢硅之外,还会生成H2和______、____。
(6)新的制取SiH2Cl2方法是:往硅粉中先通入Cl2在300-350℃反应生成SiCl4,然后再与HCl在250-260℃反应,可以大大提高产率。如果通人气体次序相反,结果会_______(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高一入学体检时,某同学体检的血液化验单中,出现了如下图所示的体检指标。表示该体检指标的物理量是( )
甘油三酯 | 0.52 | mmol/L |
总胆固醇 | 4.27 | mmol/L |
高密度脂蛋白胆固醇 | 1.57 | mmol/L |
低密度脂蛋白胆固醇 | 1.40 | mmol/L |
葡萄糖 | 4.95 | mmol/L |
A.溶解度 B.物质的量浓度 C.质量分数 D.摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.01 mol CH3COONa和0.002 mol HCl溶于水,形成1 L的混合溶液。
(1) 该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
; ; 。
(2) 该溶液中,浓度为0.01 mol/L的粒子是 ,浓度为0.002 mol/L的粒子是 。
(3) 和 两种粒子物质的量之和等于0.01 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
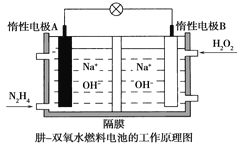
【题目】肼( N2H4)是一种高能燃料,在工业生产中用途广泛。
(1)0.5mol肼中含有_________________mol极性共价键。
(2)工业上可用肼(N2H4)与新制Cu(OH)2反应制备纳米级Cu2O,同时放出N2该反应的化学方程式为___________________。
(3)发射火箭时,肼为燃料,双氧水为氧化剂,两者反应成氮气与水蒸气。已知1.6g液态肼在上述反应中放出64.22kJ的热量,写出该反应的热化学方程式____________________________。
(4)肼-双氧水燃料电池由于其较高的能量密度而广受关注,其工作原理如图所示。则电池正极反应式为_____________________,电池工作过程中,A极区溶液的pH___________________(填“增大”“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的甲、乙同学分别设计了以下实验来验证元素周期律。
(Ⅰ)甲同学将钠,镁,铝各1mol分别投入到足量的盐酸中,预测实验结果:
(1)甲同学设计实验的目的是__________________________
(2)反应最剧烈的是______________
(3)将NaOH溶液与NH4Cl溶液混合生成NH3.H2O,从而验证NaOH的碱性强于NH3.H2O,继而验证Na的金属性大于N,你认为此设计是否合理?____________并说明理由:_____________.
(Ⅱ)乙同学设计了下图装置来探究碳、硅元素的非金属性强弱,根据要求完成下列各小题
(1)实验装置:
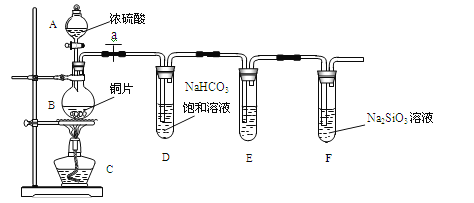
填写所示仪器名称A_________________B______________
(2)实验步骤: 连接仪器、____________、加药品后,打开a、然后滴入浓硫酸,加热。
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是________________________;
②装置E中的试剂为_________________________,作用是______________________,反应方程式_____________________________________________;
③能说明碳元素的非金属性比硅元素非金属性强的实验现象是_________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)为原料,制备粗铅,实现铅的再生利用。其工作流程如下图所示:
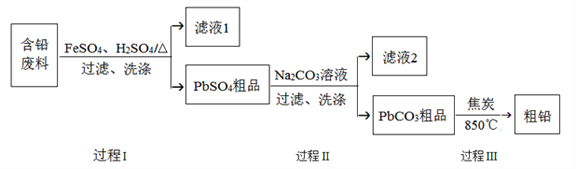
已知:Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=3.3×10-14.
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是__________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++ PbO2+4H++SO42-![]() 2Fe3++PbSO4+2H2O
2Fe3++PbSO4+2H2O
ii: ……
①写出ii的离子方程式:________________。
②下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.___________。
(3)过程Ⅱ的目的是脱硫。若滤液2中c(SO42-)=1.6mol/L,c(CO32-)=0.1mol/L,则PbCO3中____(填“是”或“否”)混有PbSO4。
(4)钠离子交换膜固相电解法是从含铅废料中提取铅的一种新工艺,其装置如图所示。将含铅废料投入阴极室,含铅废料中的PbSO4与NaOH溶液发 生反应:PbSO4+3OH-=HPbO2-+SO42-+H2O。
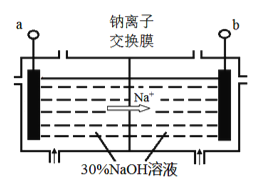
①a与外接电源的________极相连。
②电解过程中,PbO2、PbO、HPbO2-在阴极放电,其中PbO2放电的电极反应式为___________。
③与传统无膜固相电解法相比,使用钠离子交换膜可以 提高Pb元素的利用率,原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修3:物质结构与性质]
铁氧体是一种磁性材料,具有广泛的应用。 -
(1)基态铁原子的核外电子排布式为[Ar]_______。
(2)工业制备铁氧体常使用水解法,制备时常加入尿素[CO(NH2)2 ]、醋酸钠等碱性物质。尿素分子中四种不同元素的电负性由大至小的顺序是____________;醋酸钠中碳原子的杂化类型是_________。
(3)工业制备铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱。比较下表中氨(NH3)、联氨(N2H4)的熔沸点,解释其高低的主要原因________。
N2H4 | NH3 | |
熔点/℃ | 2 | -77.8 |
沸点/℃ | 113.5 | -33.5 |
(4)下图是从铁氧体离子晶体Fe3O4中,取出的能体现其晶体结构的一个立方体,则晶体中的氧离子是否构成了面心立方最密堆积______(填“是”或“否”),该立方体是不是Fe3O4的晶胞______(填“是”或“否”),立方体中三价铁离子处于氧离子围成的_____空隙(填空间结构)。
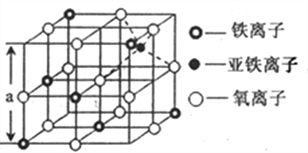
(5)解释该Fe3O4晶体能导电的原因________,根据上图计算Fe3O4晶体的密度_____gcm-3。 (图中a=0.42nm,计算结果保留两位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com