
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)为原料,制备粗铅,实现铅的再生利用。其工作流程如下图所示:
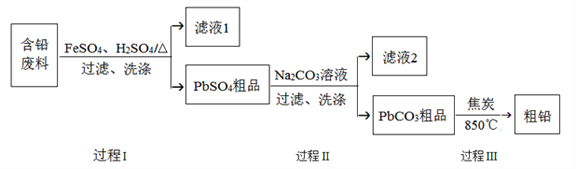
已知:Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=3.3×10-14.
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是__________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++ PbO2+4H++SO42-![]() 2Fe3++PbSO4+2H2O
2Fe3++PbSO4+2H2O
ii: ……
①写出ii的离子方程式:________________。
②下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.___________。
(3)过程Ⅱ的目的是脱硫。若滤液2中c(SO42-)=1.6mol/L,c(CO32-)=0.1mol/L,则PbCO3中____(填“是”或“否”)混有PbSO4。
(4)钠离子交换膜固相电解法是从含铅废料中提取铅的一种新工艺,其装置如图所示。将含铅废料投入阴极室,含铅废料中的PbSO4与NaOH溶液发 生反应:PbSO4+3OH-=HPbO2-+SO42-+H2O。
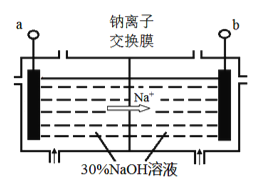
①a与外接电源的________极相连。
②电解过程中,PbO2、PbO、HPbO2-在阴极放电,其中PbO2放电的电极反应式为___________。
③与传统无膜固相电解法相比,使用钠离子交换膜可以 提高Pb元素的利用率,原因是________。
【答案】 Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O 2Fe3++Pb+ SO42-= PbSO4+2Fe2+ 取a中红色溶液少量,加入足量Pb,充分反应后,红色退去。 否 负 PbO2 + 4e- + 2H2O = Pb + 4OH- 阻止HPbO2-进入阳极室被氧化
2PbSO4+2H2O 2Fe3++Pb+ SO42-= PbSO4+2Fe2+ 取a中红色溶液少量,加入足量Pb,充分反应后,红色退去。 否 负 PbO2 + 4e- + 2H2O = Pb + 4OH- 阻止HPbO2-进入阳极室被氧化
【解析】(1)根据题给化学工艺流程知,过程Ⅰ中,在催化下,Pb、PbO2和H2SO4反应生成PbSO4和水,化学方程式为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O;
2PbSO4+2H2O;
(2)①催化剂通过参加反应,改变反应历程,降低反应的活化能,加快化学反应速率,而本身的质量和化学性质反应前后保持不变.根据题给信息知反应i中Fe2+被PbO2氧化为Fe3+,则反应ii中Fe3+被Pb还原为Fe2+,离子方程式为:2Fe3++Pb+SO42-═PbSO4+2Fe2+;
②a实验证明发生反应i,则b实验需证明发生反应ii,实验方案为:a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红,亚铁离子被氧化为铁离子;b.取a中红色溶液少量,溶液中存在平衡,Fe3++3SCN-=Fe(SCN)3,加入过量Pb,和平衡状态下铁离子反应生成亚铁离子,平衡逆向进行充分反应后,红色褪去;
(3)因为Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=3.3×10-14,c(SO42-)=1.6molL-1,c(CO32-)=0.1molL-1,PbCO3中:c(Pb2+)=![]() =3.3×10-13,;PbSO4中:Q=c(Pb2+)×c(SO42-)=3.3×10-13×1.6=5.28×10-13<Ksp(PbSO4),说明PbSO4在母液中未饱和,即PbCO3中不混有PbSO4;
=3.3×10-13,;PbSO4中:Q=c(Pb2+)×c(SO42-)=3.3×10-13×1.6=5.28×10-13<Ksp(PbSO4),说明PbSO4在母液中未饱和,即PbCO3中不混有PbSO4;
(4)①根据钠离子向阴极移动知,a为阴极,与电源负极相连;
②电解过程中,PbO2在阴极得电子,电极反应式为PbO2+4e-+2H2O=Pb+4OH-;
③钠离子交换膜只允许钠离子通过,阻止HPbO2-进入阳极室被氧化,从而提高Pb元素的利用率。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列分离方法中不正确的是( )
A.利用萃取方法用四氯化碳提取溴水中的溴单质
B.利用蒸馏的方法可以分离沸点相差较大的液体混合物
C.利用分液的方法分离酒精和水
D.利用结晶的方法除去KNO3中的氯化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种航天器能量储存系统原理示意图。下列说法正确的是( )

A.该系统中只存在3种形式的能量转化
B.装置Y中负极的电极反应式为:O2+2H2O+4e-=4OH-
C.装置X能实现燃料电池的燃料和氧化剂再生
D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)![]() Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+ H2O![]() HClO + H++Cl-K2=10-3.4
HClO + H++Cl-K2=10-3.4
HClO![]() H++ ClO-Ka=?
H++ ClO-Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。下列表述正确的是( )

A. Cl2(g)+ H2O![]() 2H++ ClO-+ Cl-K=10-10.9
2H++ ClO-+ Cl-K=10-10.9
B. 在氯处理水体系中,c(HClO) + c(ClO-) =c(H+)-c(OH-)
C. 用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时好
D. 氯处理饮用水时,在夏季的杀菌效果比在冬季差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列金属防腐的措施中,使用外加电流的阴极保护法的是( )
A. 水中的钢闸门连接电源的负极 B. 金属护栏表面涂漆
C. 汽水底盘喷涂高分子膜 D. 地下钢管连接镁块
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质间的转化通过—步反应不能实现的是
A.CO2→Na2CO3 B.FeCl3→FeCl2
C.H2SiO3→Na2SiO3 D.S→SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与有关非金属元素叙述以及推理结果不正确的是( )
①非金属性F>Cl,故将F2通入NaCl溶液中,发生反应为F2+2Cl-===Cl2+2F-
②非金属性F>Br,故酸性:HF>HBr
③非金属性S>As,故前者的气态氢化物稳定性更强
④非金属性O>N,故O2与H2化合比N2更容易
A.②③ B.③④
C.①④ D.①②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com