
| A. | 反应中,每生成1molH2转移的电子数均为2mol | |
| B. | 参加反应的金属Na、Mg、Al的物质的量之比为1:2:3 | |
| C. | 镁的物质的量为0.1mol | |
| D. | V=2.24 |
分析 Na、Mg、Al均与盐酸反应生成氢气,盐酸不足时,Mg、Al不能与水反应,而Na能与水反应生成氢气,根据氢元素守恒,可知Mg、Al与盐酸反应最多生成氢气为0.1L×2mol/L×$\frac{1}{2}$=0.1mol,其体积为0.1mol×22.4L/mol=2.24L,由关系式:2Na~H2,Mg~H2,2Al~3H2,可得生成气体与金属的物质的量关系图为: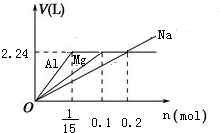 ,据此解答.
,据此解答.
解答 解:A、反应中,每生成1molH2需2mol氢离子得电子,所以转移的电子数均为2mol,故A正确;
B、Na、Mg、Al均与盐酸反应生成氢气,盐酸不足时,Mg、Al不能与水反应,而Na能与水反应生成氢气,根据氢元素守恒,可知Mg、Al与盐酸反应最多生成氢气为0.1L×2mol/L×$\frac{1}{2}$=0.1mol,其体积为0.1mol×22.4L/mol=2.24L,由关系式:2Na~H2,Mg~H2,2Al~3H2,可得生成气体与金属的物质的量关系图为: ,
,
反应生成气体的体积均为VL(标准状况下),说明反应生成氢气为2.24L,金属Al、Mg过量,Na恰好完全反应,参加反应的金属Na、Mg、Al的物质的量分别为0.2mol、0.1mol、$\frac{1}{15}$mol,参加反应的金属Na、Mg、Al的物质的量之比为0.2mol:0.1mol:$\frac{1}{15}$mol=6:3:2,综上分析可知,故B错误;
C、由B可知,镁的物质的量为0.1mol,故C正确;
D、Na、Mg、Al均与盐酸反应生成氢气,盐酸不足时,Mg、Al不能与水反应,而Na能与水反应生成氢气,根据氢元素守恒,可知Mg、Al与盐酸反应最多生成氢气为0.1L×2mol/L×$\frac{1}{2}$=0.1mol,其体积为0.1mol×22.4L/mol=2.24L,故D正确;
故选ACD.
点评 本题考查化学方程式的有关计算,属于讨论型计算,题目采取图象法便于判断金属与盐酸反应情况,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | c(H+)•c(OH-)=KW | B. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | ||
| C. | c(Na+)=c(CH3COO-)+c(OH-) | D. | c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{576V}$ mol•L-1 | B. | $\frac{a}{125}$ mol•L-1 | C. | $\frac{250a}{36V}$mol•L-1 | D. | $\frac{250a}{48V}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭、低温是存放氨水的必要条件 | |
| B. | 实验室常用排饱和食盐水法收集氯气 | |
| C. | 打开汽水瓶时,有大量气泡冒出 | |
| D. | 已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ/mol,工业上采用较高温度和使用催化剂以提高氨气的产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH(CH3)CH2CH3 2-甲基丁烷 | B. | 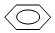 间二甲苯 间二甲苯 | ||
| C. | CH3CH2CH2CH2OH 1-羟基丁烷 | D. | 2-甲基-2-丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 雾是气溶胶,在阳光下可观察到丁达尔效应 | |
| B. | 预制备Fe(OH)3胶体,向盛有沸水的烧杯中加入FeCl3饱和溶液煮沸得红褐色沉淀 | |
| C. | 用石膏或卤水点制豆腐利用了胶体的性质 | |
| D. | 用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Cu2+、Cl-、SO42- | B. | Fe3+、K+、SO42-、NO3- | ||
| C. | H+、Mg2+、OH-、NO3- | D. | Na+、Ca2+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com