
| 1×10-14 |
| 10-5 |
| c(NH4+)?c(OH-) |
| c(NH3?H2O) |
| 1×10-14 |
| 10-5 |
| c(NH4+)?c(OH-) |
| c(NH3?H2O) |
| (0.1-10-5)×10-9 |
| 10-5 |


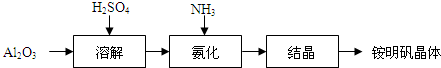
科目:高中化学 来源: 题型:
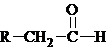 .化学式为C9H10O2的有机物A有如下的转化关系:
.化学式为C9H10O2的有机物A有如下的转化关系: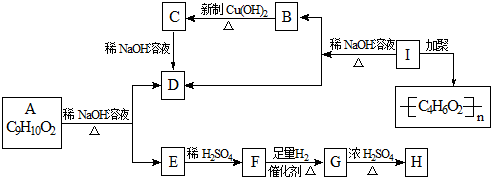
查看答案和解析>>
科目:高中化学 来源: 题型:
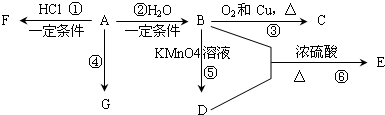
查看答案和解析>>
科目:高中化学 来源: 题型:
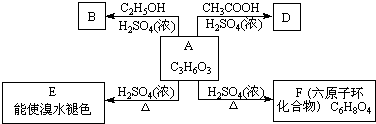
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将空气通过灼热的铜网可以除去O2 |
| B、用点燃的方法可以除去CO2中的CO |
| C、pH试纸使用前,先用蒸馏水湿润,再测定未知溶液的pH |
| D、稀释浓硫酸时,向浓硫酸中缓缓加入蒸馏水,用玻璃棒搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
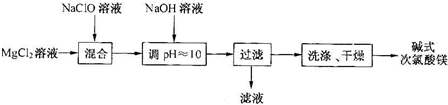
| m(Cl2) |
| m(次氯酸盐) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com