
(12 分)(原创)部分弱酸的电离平衡常数如表:
| 弱酸 | HCOOH | HNO2 | H2S | H2SO3 | H2C2O4 |
| 电离平衡常数 (25℃) | K=1.8×10﹣4 | K=5.1×10﹣4 | K1=9.1×10﹣8 K2=1.1×10﹣12 | K1=1.23×10﹣2 K2=6.6×10﹣8 | K1=5.4×10﹣2 K2=5.4×10﹣5 |
(12 分,每空2分)
(1) HNO2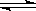 H++ NO2— (2) H2S ;HSO3-。
H++ NO2— (2) H2S ;HSO3-。
(3) H2C2O4、HCOOH、HC2O4- (4) 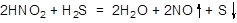
(5) D
解析试题分析:(1)HNO2为弱酸,则电离方程式为:HNO2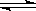 H++ NO2—
H++ NO2—
(2)电离常数越小,则弱酸的酸性越弱,所以上表的5种酸进行比较,酸性最弱的是:H2S ;酸性越强,酸根离子结合H+的能力越弱,所以HCOO-、S2-、HSO3- 3种离子中,最难结合H+的是:HSO3-。
(3)根据电离常数的大小,可知酸性由强到弱的顺序为:H2C2O4、HCOOH、HC2O4-,所以被OH—先后消耗的酸及酸式酸根依次是:H2C2O4、HCOOH、HC2O4-。
(4)HNO2具有强氧化性,H2S具有较强还原性,发生氧化还原反应,生成的沉淀为S,生成的无色气体遇空气立即变为红棕色,则无色气体为NO,所以化学方程式为: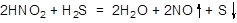
(5)A、HNO2具有强氧化性,与HS?发生氧化还原反应,而不是复分解反应,错误;B、HCOOH的酸性弱于H2SO3,所以HCOOH不能与SO32?反应生成SO2和H2O,错误;C、HSO3?的酸性弱于HCOOH,所以H2SO3与HCOO?反应生成HCOOH和HSO3?,不可能生成SO32?,错误;D、二元弱酸H2SO3与对应的酸根离子SO32?反应生成酸式酸根离子HSO3?,正确。
考点:本题考查弱电解质的电离平衡、酸性强弱的比较及应用、氧化还原反应原理、方程式的书写。


科目:高中化学 来源: 题型:单选题
已知2Al+2NaOH+2H2O 2NaAlO2+3H2。该反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)
2NaAlO2+3H2。该反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)
| A.每生成0.3 mol H2,被还原的水分子数目为0.6 NA |
| B.当有2.7 g Al参加反应时,转移的电子数目为0.3 NA |
| C.每生成6.72 L的H2,溶液中AlO2-的数目就增加0.2 NA |
| D.溶液中每增加0.1 mol的AlO2-,Na+的数目就增加0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在化学分析实验中,常常用到酸碱滴定、沉淀滴定、氧化还原滴定等。下列属于氧化还原滴定的是
| A.用标准盐酸滴定NaOH溶液 |
| B.用标准KMnO4溶液滴定FeSO4溶液 |
| C.用标准KSCN溶液滴定FeCl3溶液 |
| D.用标准AgNO3溶液滴定NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列反应既是氧化还原反应,又是吸热反应的是
| A.铝片与稀H2SO4反应 | B.Ba(OH)2·8H2O与NH4Cl的反应 |
| C.灼热的木炭与CO2反应 | D.甲烷在O2中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)某工业废水肿含有一定量的Cr2O72-和CrO42-,现
取样该工业废水,检测其中铬的含量。
步骤I:取25. 00 mL废水,加入适后稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液,滴人几滴指示剂。
步骤Ⅲ: 用o .1000 mol·L-1Na2S2O3溶液滴定(I2+2Na2 S2O3= 2NaI+Na2S4O6)
达到终点时消耗溶液24. 00 mL。
步骤Ⅳ:将上述反应后的溶液进行如下处理:反应后废液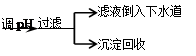
回答下列问题
(1)步骤I加入稀硫酸酸化的目的是 ;
(2)步骤Ⅱ中发生如下反应,请完善并配平离子方程式
该步骤中所加指示剂是 ;
(3)步骤Ⅲ判断滴定达到终点的现象是__ __。
(4)步骤Ⅳ在生产生活中的意义是____ (任答一条);
(5)计算工业废水中铬元素的含量是 mg/L.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式
(2)已知:Se+2H2SO4(浓) = 2SO2↑+SeO2+2H2O 2SO2+SeO2+2H2O = Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3→Se+I2+KNO3+H2O ②I2+2Na2S2O3 = Na2S4O6+2NaI
配平方程式①,标出电子转移的方向和数目
(4)实验中,准确称量SeO2样品0.1500g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂,广泛用于纺织工业。
其制备过程如下:
①把甲酸(HCOOH)和足量的NaOH溶液混合;
②用Na2SO3固体和某酸反应制备SO2气体;
③在一定温度下,将足量的SO2气体通入①的溶液中,即有保险粉生成,同时生成一种气体。
(1)写出NaOH的电子式
(2)制备SO2时所选用的酸,你认为下列最适宜选用的是
| A.浓盐酸 | B.质量分数为70%的H2SO4 |
| C.稀硝酸 | D.质量分数为10%的稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(17分)H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。
(1)某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30% H2O2、0.1mol?L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:____________
②设计实验方案:在不同H2O2浓度下,测定 ____________________________________(要求所测得的数据能直接体现反应速率大小)。
③设计实验装置,完成下图的装置示意图。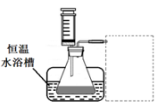
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。
(2)利用图21(a)和21(b)中的信息,按图21(c)装置(连能的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是______________________________________________________。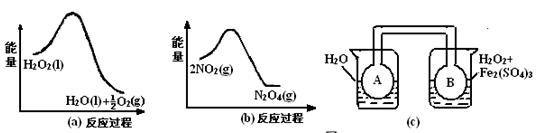
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化学知识在各个领域应用广泛。如:
(1)2003年10月15日,我国成为世界上第三个将人送入太空的国家,这次载人航天发射使用
的“长征”二号火箭使用偏二甲肼(C2H8N2)作燃料,四氧化二氮为氧化剂,燃烧主要产生CO2、N2等气体,放出的巨大能量把火箭送入太空。反应的化学方程式为: 。(2分)
(2)管道工人曾经用浓氨水检验氯气管道。如果氯气管道某处漏气,会出现白烟现象。氨与氯
气反应的化学方程式为: 。(2分)出现白烟现象的化学方程式为: 。(2分)
(3)二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂。工业生产ClO2过程是将食盐
水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。反应的化学方程式为: 。(2分)
(4)赏心悦目的雕花玻璃是用氢氟酸对玻璃进行刻蚀而制成的。这一过程中发生反应的化学方
程式为: 。(2分)
(5)维生素C在人体内有重要的功能。例如,能帮助人体将食物中摄取的、不易吸收的Fe3+转变为易吸收的Fe2+。这说明维生素C具有 。(填“氧化性”或“还原性”)(2分)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com