
����Ŀ������һ�����ˮ��Һ��ֻ���ܺ������������е������֣�Na+��Ba2+��Cl����CO32����SO42������ȡ200mL��Һ����BaCl2��Һ�ø������12.54g������������ϴ�ӡ������������Ϊ4.66g����������ʵ�飬�����ƶϲ���ȷ���ǣ� ��
A.��Һ��һ������CO32����SO42����Na+
B.��Һ��c(Na+)��0.6molL��1
C.��Һ��һ��û��Ba2+�����ܴ���Cl��
D.��Һ��n��SO42������0.02mol
���𰸡�D
��������
200mL��Һ������BaCl2��Һ�ø������12.54g������������ϴ�ӡ������������Ϊ4.66g��4.66gΪ���ᱵ�������ʵ���Ϊ![]() =0.02mol����ԭ��Һ�д���0.02molSO42-��̼�ᱵ�����ʵ���Ϊ
=0.02mol����ԭ��Һ�д���0.02molSO42-��̼�ᱵ�����ʵ���Ϊ![]() =0.04mol��ԭ��Һ�д���0.04molCO32-������������ӡ�̼��������뱵���Ӳ��ܹ��棬һ������Ba2+����ϵ���غ㣬һ�����������ӣ��������Ƿ�������жϡ�
=0.04mol��ԭ��Һ�д���0.04molCO32-������������ӡ�̼��������뱵���Ӳ��ܹ��棬һ������Ba2+����ϵ���غ㣬һ�����������ӣ��������Ƿ�������жϡ�
A. ��Һ��һ������CO32����SO42����Na+��ѡ��A��ȷ��
B. ԭ��Һ�д���0.02molSO42-��c(SO42-)=![]() =0.1mol/L������0.04molCO32-�� c(CO32-)=
=0.1mol/L������0.04molCO32-�� c(CO32-)=![]() =0.2mol/L�����ݵ���غ㣬��ֻ����SO42-��CO32-��Na+����2c(CO32-)+ 2c(SO42-)+ c(OH-)= c(Na+)+ c(H+)������ˮ�⣬c(OH-)= c(H+)������Һ��c(Na+)��0.6molL��1��ѡ��B��ȷ��
=0.2mol/L�����ݵ���غ㣬��ֻ����SO42-��CO32-��Na+����2c(CO32-)+ 2c(SO42-)+ c(OH-)= c(Na+)+ c(H+)������ˮ�⣬c(OH-)= c(H+)������Һ��c(Na+)��0.6molL��1��ѡ��B��ȷ��
C. ��Һ��һ��û��Ba2+�����ܴ���Cl����ѡ��C��ȷ��
D. ��Һ��n��SO42����=0.02mol��ѡ��D����ȷ��
��ѡD��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Կ��淴Ӧ4NH3(g)��5O2(g) ![]() 4NO(g)��6H2O(g)������������ȷ����(����)
4NO(g)��6H2O(g)������������ȷ����(����)
A. �ﵽ��ѧƽ��ʱ4v��(O2)��5v��(NO)
B. ����λʱ��������x mol NO��ͬʱ������x mol NH3����Ӧ�ﵽƽ��״̬
C. �ﵽ��ѧƽ��ʱ�������������ݻ���������Ӧ���ʼ�С���淴Ӧ��������
D. ��ѧ��Ӧ���ʹ�ϵ��2v��(NH3)��3v��(H2O)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������зḻ��ʳƷ���������Դ��ҩ���ˮ����Դ����ͼΪ��ˮ���õIJ��ֹ��̡������й�˵����ȷ����
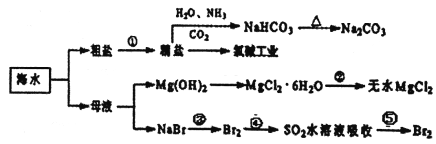
A. ��ȡNaHCO3�ķ�Ӧ���������ܽ�ȱȽ�С
B. ��ȥ����������(Mg2+��SO42-��Ca2+),�����ҩƷ˳��Ϊ:NaOH��Һ��Na2CO3��Һ��BaCl2��Һ�����˺������
C. �ڵڢۡ��ܡ��ݲ����У���Ԫ�ؾ�������
D. ��ҵ��ͨ����ⱥ��MgCl2��Һ��ȡ����þ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�������������ȷ����
A. ��ͬһ��Ͳ�Ⱥ��ȡ80 mL������20 mLˮ����������ȫ�ܽ⣬��Һ��Ϊ����ɫ
B. �ڱ������м��������������ټ���3 mLŨ���ᣬ���裬��������ɫ���ɫ
C. ���������ˮ��Һ�еμ��Ȼ�����Һ���ٵμ�˫��ˮ��������ɫ����
D. ����ȼ���þ���������������̼�ļ���ƿ��þ������ȼ�գ��а�ɫ����ɫ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʾ���ʵ��Ʊ�������������
A.ʵ���ҴӺ�������ȡ���ʵ�ȡ�����������ܽ�����������ȡ������
B.���ʯ(��Ҫ�ɷ�TiO2)Ϊԭ����������Ti�����ʯ����̿![]() TiCl4
TiCl4![]() Ti
Ti
C.��±ˮ��(������Ҫ��MgCl2)��ȡMg:±ˮ![]() Mg(OH)2
Mg(OH)2![]() MgCl2(aq)
MgCl2(aq) ![]() MgCl2(s)
MgCl2(s) ![]() Mg
Mg
D.��ʳ����ȡƯ�۾�NaCl(ag) ![]() Cl2
Cl2![]() Ư�۾�
Ư�۾�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��SO2��Na2S2O3��Na2S��Na2SO3�Ⱥ������ڹ�ҵ���й㷺����;�����������գ�
��1����ԭ�Ӻ�������Ų�ʽ____�������ӵĺ�����___��������ͬ�ĵ��ӡ�
��2��SO2���ӹ���Ϊ��V��������SO2��___��ѡ���������������Ǽ����������ӣ�����ˮ�е��ܽ�ȱ�����___��ѡ������������С������һ��������
��3����֯��������Ư����Na2S2O3��ȥ����ʱ���������·�Ӧ��___S2O32-+___Cl2+___H2O��___SO42-+___Cl-+___H+
��ƽ�÷�Ӧ����ʽ������Ӧ������2molSO42-����ת�Ƶ���____mol��
��4��Na2S�ֳƳ��������ӷ���ʽ˵��Na2S��Һ�ʼ��Ե�ԭ��___��
��5����ͼ��Na2SO3��Һ�и�����Ũ�ȵ���Դ�С��ϵʾ��ͼ�����У�����___���������ţ�����Na2SO3��Һ�и���Ũ�ȵ�ʽ��ϵ��ȷ����____��
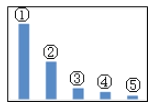
a.c(Na+)=c(SO32-)+2c(HSO3-)+2c(H2SO3)
b.c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)
c.c(OH-)=c(HSO3-)+c(H+)+c(H2SO3)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ����
A. ��������Һ������ķ�Ӧ��Na2SiO3��2H��===H2SiO3����2Na+
B. ��KIO3����������Һ�е�KI��5I����IO3����3H2O===3I2��6OH��
C. ����Na2CO3��Һ��CaSO4���巴Ӧ��CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
D. ��NaHCO3��Һ�еμ�����Ba(OH)2��Һ��Ba2����OH����HCO3��===BaCO3����H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӷ�Ӧ����ѧ��ѧ����Ҫ�ķ�Ӧ����,�ش��������⣺
��1�������������ʣ���ʯī������������Һ��CaCO3��HCl�������Ȼ��Ƣ�CH3COOH��CH4�����ǣ��������ܵ������_______�����ڵ���ʵ���_______�����ڷǵ���ʵ���_______�������������
��2��д�����з�Ӧ���ӷ���ʽ
��NaHCO3��Һ��NaHSO4��Һ��Ӧ��_________��
��NaHCO3��Һ��NaOH��Һ��Ӧ��_______��
��ij��ɫ�����ˮ��Һ ,���ܺ������������е������֣�![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��ȡ100mL����Һ��������ʵ�飺
��ȡ100mL����Һ��������ʵ�飺
��1�������Һ�м�������ϡ����,�ڱ�״���·ų�![]() ����
����![]() ��������ڱ�״���²ⶨ���Ҳ����������ܽ�
��������ڱ�״���²ⶨ���Ҳ����������ܽ�![]() ��
��
��2����I�����õ���Һ�еμ�����![]() ��Һ������ɫ����
��Һ������ɫ����![]() ���Իش��������⣺
���Իش��������⣺
�϶����ڵ�������_______���϶������ڵ�������______�� ���ܴ��ڵ�������_____�� �϶����ڵ���������ԭ��Һ�е����ʵ���Ũ������Ϊ_____________��
Ϊ�˼��������ƶ�,��ʵ��ķ���ȷ����Һ���Ƿ���ڵ�һ���п϶����ڵ������Ӻ͵������п��ܴ��ڵ����ӣ�
��һ��������Һ�еμӹ�����________��Һ![]() �ѧʽ
�ѧʽ![]() ��������Ӧ�����ӷ���ʽΪ___________��
��������Ӧ�����ӷ���ʽΪ___________��
�ڶ��������������_________��Һ![]() �ѧʽ
�ѧʽ![]() ,��Ŀ����_____________��
,��Ŀ����_____________��
������������,������Һ�м���___________��Һ![]() �ѧʽ
�ѧʽ![]() ,������Ӧ�����ӷ���ʽΪ___________��
,������Ӧ�����ӷ���ʽΪ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���������
A. 2H2S+SO2=3S��+2H2O�У���������ͻ�ԭ�������ʵ���֮��Ϊ2:1
B. 4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O�У��������ͻ�ԭ�����ʵ���֮��Ϊ5:2
C. 3I2+6KOH![]() 5KI+KIO3+3H2O�У��������ͱ���ԭ�ĵ�ԭ�����ʵ���֮��Ϊ1:5
5KI+KIO3+3H2O�У��������ͱ���ԭ�ĵ�ԭ�����ʵ���֮��Ϊ1:5
D. 2FeS+6H2SO4(Ũ)![]() Fe2(SO4)3+3SO2��+2S��+6H2O�У�����������Ӧ�ͷ�����ԭ��Ӧ����ԭ�����ʵ���֮��Ϊ2:3
Fe2(SO4)3+3SO2��+2S��+6H2O�У�����������Ӧ�ͷ�����ԭ��Ӧ����ԭ�����ʵ���֮��Ϊ2:3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com