
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程。下列有关说法正确的是
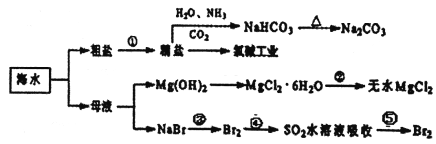
A. 制取NaHCO3的反应是利用其溶解度比较小
B. 除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
C. 在第③、④、⑤步骤中,溴元素均被氧化
D. 工业上通过电解饱和MgCl2溶液制取金属镁
【答案】A
【解析】A.碳酸氢钠在反应涉及物质中溶解度最小,向饱和食盐水中通入氨气以及二氧化碳,溶解度较小的碳酸氢钠会先析出,制取NaHCO3的反应是利用其溶解度小于NaCl,故A正确;B.除去粗盐中杂质(Mg2+、SO42-、Ca2+),BaCl2溶液需要在碳酸钠之前加入,便于过量的氯化钡被碳酸钠除去,故B错误;C.海水提溴是先通入足量氯气氧化溴离子为溴单质,然后将溴单质还原为溴化氢,再通入适量氯气氧化溴离子为溴单质,其中④中溴得电子化合价降低,所以溴元素被还原,故C错误;D.镁为活泼金属,电解氯化镁溶液,在阳极生成氯气,在阴极生成氢气和氢氧化镁沉淀,不能得到镁,应用电解熔融氯化镁的方法冶炼,故D错误;故选A。


科目:高中化学 来源: 题型:
【题目】碘是人体中不可缺少的元素,为了预防碘缺乏,通常在精盐中添加一定的KIO3。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关资料,发现其检测原理是:KIO3 + 5KI + 3H2SO4 = 3I2 + 3K2SO4 + 3H2O
(1)用双线桥表示该反应中电子转移的方向和数目___________________________________,该反应中还原产物与氧化产物的质量之比是__________,0.2mol KIO3参加反应时,转移的电子为________mol。
(2)上面实验中用到一定物质的量浓度的稀硫酸,若配制1.0 mol/L的稀硫酸500mL,配制中需要用到的主要玻璃仪器有___________(填选项),需用18.0mol/L 浓硫酸_________mL。
a.100mL量筒 b.玻璃棒 c.100mL容量瓶 d.50mL量筒 e.胶头滴管
f.烧杯 g.500mL容量瓶
(3)下面操作造成所配稀硫酸溶液浓度偏高的有____________(填选项)。
a.溶解后溶液没有冷却到室温就转移;b.转移时没有洗涤烧杯、玻璃棒;c.转移过程中有少量液体流出;d.向容量瓶加水定容时眼睛俯视液面;e.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g) ![]() B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
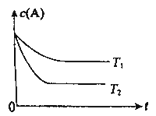
(1)上述反应的温度T1____ T2,平衡常数K(T1)____K(T2)。(填“大于”、“小于”或“等于”)
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为________。
②反应的平衡常数K=_______。
③反应在0~5min区间的平均反应速率v(A)=________。
(3)已知1g FeS2完全燃烧放出7.1kJ热量,FeS2燃烧反应的热化学方程式为______。
(4)物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)2 ![]() 2(t-BuNO) ΔH = 50.5 kJ·mol-1。该反应的ΔS_____0(填“>”、“<”或“=”)。在______填“较高”或“较低”)温度下有利于该反应自发进行。
2(t-BuNO) ΔH = 50.5 kJ·mol-1。该反应的ΔS_____0(填“>”、“<”或“=”)。在______填“较高”或“较低”)温度下有利于该反应自发进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。试回答:

(1)若X是强氧化性单质,则A不可能是____。
a.S b.N2 c.Na d.Mg e.Al
(2)若A为强碱溶液,则X可能为____。
a.CO2 b.AlCl3 c.Al d.Mg e.Al2O3
(3)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为____;C溶液在贮存时应加入少量X,理由是(离子方程式表示)___,检验此C溶液中金属元素价态的操作方法是____。
(4)若A、B、C为含有金属元素的化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为____,X的化学式可能为(写出不同类物质)____或____,反应②的离子方程式为___或___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法正确的是( )
A.1 molNaHCO3与足量盐酸反应放出CO2气体的体积为22.4L
B.1 mol Al3+离子含有的核外电子数为3NA
C.7.8g过氧化钠与足量水反应,转移电子数为0.1NA
D.O2和O3的混合气体,质量为48g,所含氧原子数为1.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.碘酸钾(KIO3)是一种白色或无色固体,可溶于水,具有较强的氧化性。常添加于食盐中用以防治碘缺乏病。已知在某反应体系中存在以下几个物质: KIO3、K2SO4、KI、I2、H2SO4、H2O。
(1)书写并配平该反应方程式,并标出电子转移的方向和数目:_________________;
(2)下列说法中正确的是_________。
A.I2是非电解质 B.K2SO4溶液的导电能力一定比KI溶液的强
C.H2SO4没有参加氧化还原反应 D.氧化产物和还原产物都是I2
Ⅱ.二氧化氯(ClO2)是高效安全的饮用水消毒剂,得到越来越广泛的应用,实验室可用KClO3通过以下反应制得:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O
试回答下列问题。
(3)该反应中还原产物的化学式是_________;被氧化的元素是_________。
(4)生成标况下4.48LCO2,电子转移数是_______________。
(5)ClO2和Cl2均能将电镀废水中的CN 反应为无毒的物质,自身反应后均生成Cl,此过程说明ClO2和Cl2均具有_________ (填“氧化”或“还原”)性。处理含相同量CN的电镀废水,所需Cl2的物质的量是ClO2的_________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
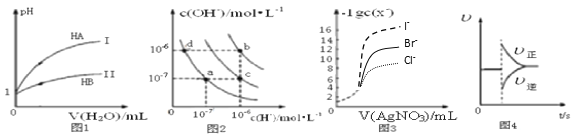
A. 图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则等物质的量浓度的NaA和NaB混合溶液中:c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+)
B. 图2中在b点对应温度下,将pH=2的H2SO4溶液与pH=12的NaOH溶液等体积混合后,溶液显中性
C. 用0.0100 mol/L硝酸银标准溶液,滴定浓度均为0.1000 mol/L Cl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl-
D. 图4表示在N2(g)+3H2(g) ![]() 2NH3(g)达到平衡后,减小NH3浓度时速率的变化
2NH3(g)达到平衡后,减小NH3浓度时速率的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物水溶液,只可能含有以下离子中的若干种:Na+、Ba2+、Cl﹣、CO32﹣、SO42﹣,现取200mL溶液加入BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。根据上述实验,以下推断不正确的是( )
A.溶液中一定存在CO32﹣、SO42﹣、Na+
B.溶液中c(Na+)≥0.6molL﹣1
C.溶液中一定没有Ba2+,可能存在Cl﹣
D.溶液中n(SO42﹣)≤0.02mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol过氧化钠与1.6mol碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是 ( )
A. Na2CO3 B. NaOH、Na2CO3 C. Na2O2、 Na2CO3 D. Na2O2、 NaOH 、Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com