
【题目】离子反应是中学化学中重要的反应类型,回答下列问题:
Ⅰ.(1)现有下列物质:①石墨②氢氧化钠溶液③CaCO3④HCl⑤熔融氯化钠⑥CH3COOH⑦CH4⑧蔗糖),其中能导电的是_______,属于电解质的是_______,属于非电解质的是_______。(用序号作答)
(2)写出下列反应离子方程式
①NaHCO3溶液与NaHSO4溶液反应:_________。
②NaHCO3溶液与NaOH溶液反应:_______。
Ⅱ.某无色混合物水溶液 ,可能含有以下离子中的若干种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。取100mL该溶液进行如下实验:
。取100mL该溶液进行如下实验:
(1)向该溶液中加入足量稀盐酸,在标准状况下放出![]() 气体
气体![]() 气体体积在标准状况下测定,且不考虑气体溶解
气体体积在标准状况下测定,且不考虑气体溶解![]() ;
;
(2)向I中所得的滤液中滴加足量![]() 溶液产生白色沉淀
溶液产生白色沉淀![]() ;试回答下列问题:
;试回答下列问题:
肯定存在的离子有_______,肯定不存在的离子有______; 可能存在的离子是_____; 肯定存在的阳离子在原溶液中的物质的量浓度至少为_____________;
为了检验以上推断,用实验的方法确定溶液中是否存在第一问中肯定存在的阴离子和第三问中可能存在的离子:
第一步:向溶液中滴加过量的________溶液![]() 填化学式
填化学式![]() ,发生反应的离子方程式为___________。
,发生反应的离子方程式为___________。
第二步:加入过量的_________溶液![]() 填化学式
填化学式![]() ,其目的是_____________;
,其目的是_____________;
第三步:过滤,再向滤液中加入___________溶液![]() 填化学式
填化学式![]() ,发生反应的离子方程式为___________。
,发生反应的离子方程式为___________。
【答案】①②⑤ ③④⑤⑥ ⑦⑧ HCO3-+ H+ = CO2↑+ H2O HCO3- + OH- = CO32-+ H2O CO32-、![]() 、K+ Mg2+、Fe3+、Ba2+ Cl- 0.7mol/L HNO3 2H++CO32-=CO2↑+H2O Ba(NO3)2 检验硫酸根离子并除去 AgNO3 Ag++Cl-=AgCl↓
、K+ Mg2+、Fe3+、Ba2+ Cl- 0.7mol/L HNO3 2H++CO32-=CO2↑+H2O Ba(NO3)2 检验硫酸根离子并除去 AgNO3 Ag++Cl-=AgCl↓
【解析】
根据电解质与非电解质概念分析解答;根据NaHCO3与NaHSO4的电离特点及离子方程式书写规则书写相关离子方程式;根据常见阴离子的检验方法选择适当试剂和滴加顺序分别进行检验,并书写相关离子方程式。
Ⅰ.(1)①石墨中含有自由移动的电子,可以导电,②氢氧化钠溶液和⑤熔融氯化钠中存在自由移动的离子,可以导电,故能导电的是:①②⑤;③CaCO3是盐,④HCl是酸,⑤熔融氯化钠是盐,⑥CH3COOH是酸,所以属于电解质的是③④⑤⑥;⑦CH4和⑧蔗糖在水溶液里和熔融状态下都不导电,是非电解质,故属于非电解质的是⑦⑧, 故答案为:①②⑤;③④⑤⑥; ⑦⑧ ;
(2)①NaHSO4溶液相当于强酸溶液,与NaHCO3溶液反应生成硫酸钠、二氧化碳和水,离子方程式为:HCO3-+ H+ = CO2↑+ H2O;
②NaHCO3溶液与NaOH溶液反应生成碳酸钠和水,离子方程式为:HCO3- + OH- = CO32-+ H2O;
故答案为:HCO3-+ H+ = CO2↑+ H2O;HCO3- + OH- = CO32-+ H2O;
Ⅱ.无色溶液中不存在有色的Fe3+离子,
(1)向该溶液中加入足量稀盐酸,在标准状况下放出0.56L气体,说明溶液中存在CO32-,并且物质的量为![]() =0.025mol,则一定不存在Mg2+、Ba2+;
=0.025mol,则一定不存在Mg2+、Ba2+;
(2)向I中所得的滤液中滴加足量BaCl2溶液产生白色沉淀2.33g,2.33g为硫酸钡,说明溶液中存在SO42-,并且物质的量为![]() =0.01mol;
=0.01mol;
根据以上分析,原溶液中一定存在CO32、SO42,一定不存在Mg2+、Fe3+、Ba2+,根据电荷守恒,则原溶液中一定含有K+;可能存在的是Cl-;碳酸根和和硫酸根所带的负电荷数为:0.025mol×2+0.01mol×2=0.07mol,则肯定存在的K+在原溶液中的物质的量浓度至少为![]() ;
;
故答案为: CO32-、![]() 、K+ ; Mg2+、Fe3+、Ba2+ ; Cl-;0.7mol/L;
、K+ ; Mg2+、Fe3+、Ba2+ ; Cl-;0.7mol/L;
检验CO32-、![]() 和Cl-的存在,为了不引入
和Cl-的存在,为了不引入![]() 和Cl-,先加入硝酸溶液,与碳酸根反应生成二氧化碳气体,离子方程式为:2H++CO32-=CO2↑+H2O;检验
和Cl-,先加入硝酸溶液,与碳酸根反应生成二氧化碳气体,离子方程式为:2H++CO32-=CO2↑+H2O;检验![]() 时,加入过量的Ba(NO3)2溶液,同时将硫酸根除去;第三步检验Cl-,向滤液中加入AgNO3;反应的离子方程式为:Ag++Cl-=AgCl↓;
时,加入过量的Ba(NO3)2溶液,同时将硫酸根除去;第三步检验Cl-,向滤液中加入AgNO3;反应的离子方程式为:Ag++Cl-=AgCl↓;
故答案为:HNO3; 2H++CO32-=CO2↑+H2O;Ba(NO3)2 ;检验硫酸根离子并除去;AgNO3;Ag++Cl-=AgCl↓。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。试回答:

(1)若X是强氧化性单质,则A不可能是____。
a.S b.N2 c.Na d.Mg e.Al
(2)若A为强碱溶液,则X可能为____。
a.CO2 b.AlCl3 c.Al d.Mg e.Al2O3
(3)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为____;C溶液在贮存时应加入少量X,理由是(离子方程式表示)___,检验此C溶液中金属元素价态的操作方法是____。
(4)若A、B、C为含有金属元素的化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为____,X的化学式可能为(写出不同类物质)____或____,反应②的离子方程式为___或___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物水溶液,只可能含有以下离子中的若干种:Na+、Ba2+、Cl﹣、CO32﹣、SO42﹣,现取200mL溶液加入BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。根据上述实验,以下推断不正确的是( )
A.溶液中一定存在CO32﹣、SO42﹣、Na+
B.溶液中c(Na+)≥0.6molL﹣1
C.溶液中一定没有Ba2+,可能存在Cl﹣
D.溶液中n(SO42﹣)≤0.02mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室干馏煤的装置图,结合下图回答问题。

(1)指出图中仪器名称:a__________;b__________;c__________;d__________。
(2)装置c的作用是____________________________________,d中的液体有________和________。有机物可以通过________的方法使其中的重要成分分离出来。
(3)e处点燃的气体是________,火焰的颜色是________色。
(4)下列叙述错误的是________。
A.煤发生了化学变化
B.d中液体显碱性
C.d中液体不分层
D.e处的气体可以还原氧化铜,也可以使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。
ZnO(s)+2Ni(OH)2(s)。

A. 三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B. 充电时阳极反应为Ni(OH)2(s)+OH(aq)e![]() NiOOH(s)+H2O(l)
NiOOH(s)+H2O(l)
C. 放电时负极反应为Zn(s)+2OH(aq)2e![]() ZnO(s)+H2O(l)
ZnO(s)+H2O(l)
D. 放电过程中OH通过隔膜从负极区移向正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个绝热的、容积固定的密闭容器中,发生可逆反应mA(g)+nB(g)![]() pC(g)+qD(g)(m、n、p、q为任意正整数)。下列能说明该可逆反应达到平衡状态的是( )
pC(g)+qD(g)(m、n、p、q为任意正整数)。下列能说明该可逆反应达到平衡状态的是( )
①混合气体的密度不再发生变化 ②体系的温度不再发生变化 ③A的转化率不再改变 ④各组分的百分含量不再改变 ⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
A. ②③④B. ①③⑤C. ②④⑤D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol过氧化钠与1.6mol碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是 ( )
A. Na2CO3 B. NaOH、Na2CO3 C. Na2O2、 Na2CO3 D. Na2O2、 NaOH 、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表述正确的是
A. 钢铁吸氧腐蚀中的正极反应:4OH--4e-=2H2O +O2
B. 由Na和Cl形成离子键的过程:![]()
C. NaHCO3的水解平衡:HCO3-+H2O ![]() H3O++CO32-
H3O++CO32-
D. 实验室制乙炔的反应:CaC2+H2O →CaO+C2H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列装置测定空气中SO2的含量,A溶液最好选用
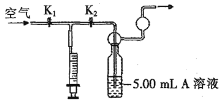
A.NaOH溶液(滴有2-3滴酚酞溶液)
B.KMnO4溶液(滴有-定量硫酸溶液)
C.HNO3溶液(滴有2-3滴Ba(NO3)2溶液)
D.I2溶液(滴有2-3滴淀粉溶液)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com