
【题目】下列有机化合物的说法正确的是( )
A.用浓硫酸和乙醇在加热条件下制备乙烯,应该迅速升温到140℃
B.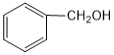 与
与 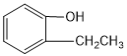 互为同系物
互为同系物
C.冬天汽车里用的防冻液是乙醇
D.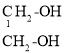 CH3CH2OH CH3CH2CH3三者沸点、溶解度依次降低
CH3CH2OH CH3CH2CH3三者沸点、溶解度依次降低
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】人体血液存在![]() 、
、![]() 等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值lgx[x表示
等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值lgx[x表示![]() 或
或![]() ]与
]与![]() 的关系如图所示。已知碳酸
的关系如图所示。已知碳酸![]() 、磷酸
、磷酸![]() 。则下列说法正确的是
。则下列说法正确的是

A.曲线![]() 表示lg(
表示lg(![]() )与
)与![]() 的变化关系
的变化关系
B.![]() 的过程中,水的电离程度逐渐减小
的过程中,水的电离程度逐渐减小
C.当![]() 时
时![]()
D.当![]() 增大时,
增大时,![]() 逐渐减小
逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124 g P4中所含P—P键数目为4NA
B. 100 mL 1mol·L1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Fe(NO3)3和Cu(NO3)2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示,则该溶液中Fe(NO3)3与Cu(NO3)2的物质的量浓度之比为
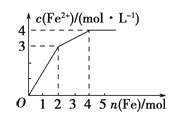
A.3∶1 B.1∶2 C.2∶1 D.1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Cu都是重要的材料元素,其单质及化合物在诸多领域中都有广泛的应用。
(1)Fe位于元素周期表的_____区,Fe2+的价层电子排布图为_____。
(2)向黄色的三氯化铁溶液中加入无色的KSCN溶液,溶液变成红色。该反应在有的教材中用方程式FeCl3+3KSCN=Fe(SCN)3+3KCl表示。经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1∶3的个数比配合,还可以其他个数比配合。请按要求填空:
①所得Fe3+与SCN-的配合物中,主要是Fe3+与SCN-以个数比1∶1配合所得离子显红色。含该离子的配合物的化学式是____。
②铁的另一种配合物铁氰化钾K3[Fe(CN)6]俗称赤血盐,可用于检验Fe2+,两者反应生成带有特征蓝色的沉淀,请用离子方程式说明原理_____,该赤血盐其配体的电子式为:_____。
(3)Cu的某种化合物的结构如图所示,该化合物中既含有配位键,又含有氢键,其中配位键和氢键均采用虚线表示。
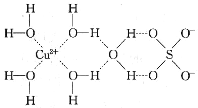
0.5mol该化合物中含有σ键的个数为_____。Cu2+与NH3还可形成[Cu(NH3)4]2+配离子,该配离子的立体构型为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在抗击新冠肺炎的过程中,科研人员研究了法匹拉韦、利巴韦林、氯硝柳胺等药物的疗效,三种药物主要成分的结构简式如下。下列说法不正确的是
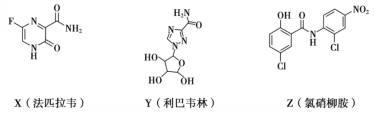
A.X的分子式为C5H4O2N3F
B.Z中含有6种官能团
C.Y和Z都有羟基,但性质不完全相同
D.X和Z都能发生加成反应和水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具![]() 水热法制备Fe3O4纳米颗粒的反应是:3Fe2+ + 2S2O32-+ O2 + xOH- = Fe3O4↓+ S4O62- + 2H2O 。下列说法不正确的是
水热法制备Fe3O4纳米颗粒的反应是:3Fe2+ + 2S2O32-+ O2 + xOH- = Fe3O4↓+ S4O62- + 2H2O 。下列说法不正确的是![]()
![]()
A.参加反应的氧化剂与还原剂的物质的量之比为1:5
B.若有2molFe2+ 被氧化,则被Fe2+还原的O2的物质的量为0.5mol
C.每生成1molFe3O4,反应转移的电子为4mol
D.O2是氧化剂,S2O32-与Fe2+是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、M、R为6种短周期元素。W原子的核电荷数等于其周期数,X+与Ne具有相同的电子层结构,Y原子与Z原子的最外层电子数之和与R原子的最外层电子数相等;Y、Z、M、R在周期表中的相对位置如图所示。
Z | M | R | ||
Y |
(1)Z元素在周期表的位置为________。
(2)R离子的结构示意图为_________。
(3)X与M以1:1形成的化合物中存在的化学键类型为____________。
(4)Y的最高价氧化物与X的最高价氧化物的水化物在水溶液中发生反应的离子方程式为_________________________________。
(5)Y与Z 形成相对分子量为144的化合物与M的简单氢化物反应,生成最简单的烃和Y的最高价氧化物的水化物,该反应的化学方程式为__________________________。
(6)M与R可形成M2R2分子,该分子中各原子均达到8电子稳定结构,则M2R2的电子式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“中和滴定”原理在实际生产生活中应用广泛。用I2O5可定量测定CO的含量,该反应原理为5CO+I2O5![]() 5CO2+I2。其实验步骤如下:
5CO2+I2。其实验步骤如下:
①取250 mL(标准状况)含有CO的某气体样品通过盛有足量I2O5的干燥管中在170 ℃下充分反应;
②用水一乙醇液充分溶解产物I2,配制100 mL溶液;
③量取步骤②中溶液25.00 mL于锥形瓶中,然后用0.01 mol·L-1的Na2S2O3标准溶液滴定。消耗标准Na2S2O3溶液的体积如表所示。
第一次 | 第二次 | 第三次 | |
滴定前读数/mL | 2.10 | 2.50 | 1.40 |
滴定后读数/mL | 22.00 | 22.50 | 21.50 |
(1)步骤②中配制100 mL待测溶液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和____________________。
(2)Na2S2O3标准液应装在__________(填字母)中。

(3)指示剂应选用__________,判断达到滴定终点的现象是____________________________________。
(4)气体样品中CO的体积分数为__________(已知:气体样品中其他成分不与I2O5反应:2Na2S2O3+I2=2NaI+Na2S4O6)
(5)下列操作会造成所测CO的体积分数偏大的是__________(填字母)。
a.滴定终点俯视读数
b.锥形瓶用待测溶液润洗
c.滴定前有气泡,滴定后没有气泡
d.配制100 mL待测溶液时,有少量溅出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com