
【题目】化学与生产生活有密切的联系。下列关于化学物质应用的说法错误的是![]()
A.84消毒液和洁厕灵不能混合使用
B.![]() 可作葡萄酒的防腐剂
可作葡萄酒的防腐剂
C.醋酸可用于除水垢是由于碳酸的酸性比醋酸强
D.![]() 过硫酸氢钾
过硫酸氢钾![]() 可用于游泳的杀菌消毒是由于它能使蛋白质变性
可用于游泳的杀菌消毒是由于它能使蛋白质变性![]()
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】氨气是一种重要的化工原料,在工农业中都有广泛的应用。
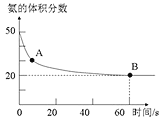
(1)NH3和CO2在120℃和催化剂的作用下可以合成尿素,反应方程式如下:2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)。某实验小组向一个容积不变的真空密闭容器中充入![]() 与
与![]() 合成尿素。在恒定温度下,混合气体中
合成尿素。在恒定温度下,混合气体中![]() 的含量随时间的变化关系如图所示
的含量随时间的变化关系如图所示![]() 该条件下尿素为固体
该条件下尿素为固体![]() 。A点的正反应速率
。A点的正反应速率![]() ______ B点的逆反应速率
______ B点的逆反应速率![]() 填“大于”、“小于”或“等于”
填“大于”、“小于”或“等于”![]() ,
,![]() 的平衡转化率为______。
的平衡转化率为______。
(2)氨基甲酸铵![]() 是合成尿素过程中的中间产物。现将体积比为2:1的
是合成尿素过程中的中间产物。现将体积比为2:1的![]() 和
和![]() 混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:
混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:![]() 。实验测得在不同温度下的平衡数据如表:
。实验测得在不同温度下的平衡数据如表:
温度 |
|
|
|
|
|
平衡气体总浓度 |
|
|
|
|
|
①上述反应的焓变:![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”,下同
”,下同![]() ,熵变
,熵变![]() ______
______![]() 根据表中数据,列出
根据表中数据,列出![]() 时该反应的化学平衡常数的计算式
时该反应的化学平衡常数的计算式![]() ______
______![]() 不要求计算结果
不要求计算结果![]() 。
。
②若从已达平衡状态的上述容器中分离出少量的氨基甲酸铵晶体,反应物的转化率将______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() 。
。
(3)向含![]() 的溶液中滴加bL氨水后溶液恰好呈中性,则滴加氨水的过程中水的电离平衡将______
的溶液中滴加bL氨水后溶液恰好呈中性,则滴加氨水的过程中水的电离平衡将______![]() 填“正向”、“不”或“逆向”
填“正向”、“不”或“逆向”![]() 移动,所滴加氨水的浓度为______
移动,所滴加氨水的浓度为______ ![]() 时,
时,![]() 的电离平衡常数
的电离平衡常数 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其他产物及反应条件已略去,反应可以在水溶液中进行):![]() 。三种物质的焰色反应均为黄色;C常作面包和糕点的发泡剂,受热分解可生成B。
。三种物质的焰色反应均为黄色;C常作面包和糕点的发泡剂,受热分解可生成B。
(1)写出下列物质的化学式A______,B________,C________,W________。
(2)写出A溶液与C溶液反应的离子方程式为_______________________________。
(3)向两份30 mL同浓度的A溶液中通入不同体积的W气体,得到溶液M、N。向M、N溶液中逐滴加入浓度为0.25 mol·L-1盐酸,如图所示Ⅰ和Ⅱ分别为加入V(盐酸)与产生V(W)的关系。通过计算确定A溶液的物质的量浓度为 _______________。
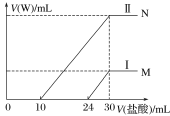
(4)M、N两溶液中相同溶质的物质的量之比为多少_______?(写出必要的文字说明和计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用二氧化锰和浓盐酸反应制取Cl2,化学方程式如下:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)请用单线桥标出该反应电子转移的方向和数目__,该反应的氧化产物是__。
(2)其中氧化剂与还原剂的物质的量之比是__;若实验中有87g的MnO2完全反应,则制得的Cl2在标况下的体积是__L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是
A.异戊二烯(![]() )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
B.2氯丁烷与NaOH乙醇溶液共热发生消去HCl分子的反应
C.甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应
D.邻羟基苯甲酸与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁有两种氯化物,都是重要的化工试剂。查阅有关资料如下:
(氯化铁)熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。
(氯化亚铁)熔点为670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
某化学活动小组用下图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:
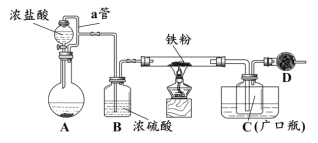
(1)在装置A中,用KMnO4与浓盐酸反应制取氯气,反应的离子方程式为_________。仪器D的名称是__________________。
(2)D中装的药品是碱石灰,其作用是__________________________。
(3)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有FeCl2,可用下列试剂中的_____(只能选取一种试剂,填序号)进行检测,实验现象是__________________________________。
①H2O2 溶液 ②KI-淀粉溶液 ③KSCN溶液 ④酸性KMnO4溶液
(4)定量分析。取装置C中的产物,按以下步骤进行测定:①称取4.60g产品溶于过量的稀盐酸中;②加入足量H2O2溶液;③再加入足量NaOH溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40g。
则该样品中铁元素的质量分数为_______%(结果精确到小数点后两位)。
(5)由(4)定量分析数据得出结论,并提出改进措施。
①用题目所给的装置制得的产物中,铁元素含量______(填“相等”、“偏高”或“偏低”),说明含有FeCl2杂质。
②若要得到较纯净的无水氯化铁,可采取的“装置”改进措施是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】破坏![]() 物质中的化学键所消耗的能量如表所示:
物质中的化学键所消耗的能量如表所示:
物质 |
|
|
|
|
|
|
|
能量/ | 243 | 193 | 151 | 431 | 363 | 297 | 436 |
根据上述数据回答下列问题。
(1)下列物质本身具有的能量最低的是________(填序号)。
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
(2)下列氢化物中,最稳定的是________(填序号)。
A. ![]() B.
B. ![]() C.
C. ![]()
(3)相同条件下,![]() (
(![]() 代表
代表![]() 、
、![]() 、
、![]() )分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是________。
)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)N2H4可作火箭推进剂,NH3和NaClO在一定条件下反应可生成N2H4。
①写出NH3和NaClO反应生成N2H4的_____;
②已知25℃时N2H4水溶液呈弱碱性:
N2H4+H2O![]() N2H5++OH- K1=1×10-a;N2H5++H2O
N2H5++OH- K1=1×10-a;N2H5++H2O![]() N2H62++OH- K2=1×10-b。
N2H62++OH- K2=1×10-b。
25℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),应控制溶液中c(OH-)的范围为_____________________(用含a、b式子表示)。
(2)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中:c(NH4+)_____c(HCO3-)(填“>”、“<”或“=”);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=_________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×107mol·L1,K2=4×1011mol·L1)
NH3·H2O+H2CO3的平衡常数K=_________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×107mol·L1,K2=4×1011mol·L1)
(3)25℃,将amol·L1的HCOONa溶液与0.01mol·L1盐酸等体积混合,反应后测得溶液的pH=7,则Ka=_____________。(用含a的代数式表示不用化简,不考虑液体混合时体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某2 L恒容密闭容器中充入2 mol X(g)和1 mol Y(g)发生反应:2X(g)+Y(g)![]() 3Z(g),反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
3Z(g),反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
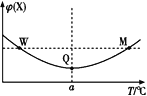
A.M点时,Y的转化率最大B.升高温度,平衡常数减小
C.W点时 v正 = v逆D.W、M两点Y的正反应速率相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com