
下图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格:
(1)在这10种元素中,非金属性最强的是 (填序号);
(2)元素②⑧⑨以原子个数比1:1:1形成的化合物的结构式为 ,元素②与⑨形成的18e-化合物的电子式 ;
(3)②⑨⑩三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M中含有的化学键类型有 ;
(4)比较元素⑦⑧形成的气态氢化物的稳定性: > (用化学式表示)
(5)元素⑤的氧化物与氢氧化钠溶液反应的离子方程式 。
(6)元素④和③形成的化合物属于 化合物,用电子式表示其形成过程 。
(1)③;(2)H—O—Cl; H∶O∶O∶H ;(3)离子键和共价键
(4)HCl> H2S。(5)Al2O3+2OH-=2AlO2-+H2O (6)离子 电子式形成过程
解析试题分析:(1)在同一周期的元素中,元素的原子序数越大,元素的非金属性越强,在不同周期的元素中,元素的原子核外的电子层数越少,元素的非金属性越强。因此在这些元素中非金属性最强的是③F元素。(2)元素O、Cl、H三元素以原子个数比1:1:1形成的化合物HClO的结构式为H—O—Cl。元素O、H形成的18e-化合物H2O2的电子式为 。(3)H、N、O三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M为NH4NO3。该化合物为在化合物,其中含有的化学键类型有离子键、共价键。(4)S、Cl是同一周期的元素。元素的元素半径越小,元素得到电子的能力就越强,元素的非金属性就越强。元素结合H形成的氢化物的稳定性就越强。所以稳定性HCl>H2S。(5)元素⑤是Al,其氧化物Al2O3是两性氧化物,既能与强酸反应液能与强碱发生反应。生成盐和水。Al2O3与NaOH溶液反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O。(6)④元素Mg和③元素F形成的化合物MgF2属于离子化合物,用电子式表示其形成过程为:
。(3)H、N、O三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M为NH4NO3。该化合物为在化合物,其中含有的化学键类型有离子键、共价键。(4)S、Cl是同一周期的元素。元素的元素半径越小,元素得到电子的能力就越强,元素的非金属性就越强。元素结合H形成的氢化物的稳定性就越强。所以稳定性HCl>H2S。(5)元素⑤是Al,其氧化物Al2O3是两性氧化物,既能与强酸反应液能与强碱发生反应。生成盐和水。Al2O3与NaOH溶液反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O。(6)④元素Mg和③元素F形成的化合物MgF2属于离子化合物,用电子式表示其形成过程为: 。
。
考点:考查元素及化合物的推断、元素的非金属性的比较、物质的电子式、结构式、离子方程式的书写、用电子式表示物质的形成过程的知识。


科目:高中化学 来源: 题型:填空题
【化学--选修3物质结构与性质】(15分)
铜、铁都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。
请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下: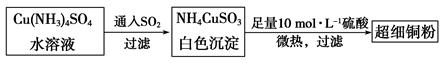
①Cu2+的价电子排布图 ; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为_______________________(填元素符号)。
②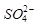 的空间构型为_____________,
的空间构型为_____________,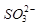 离子中心原子的杂化方式为 。
离子中心原子的杂化方式为 。
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式: 。
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。
①下列说法正确的是
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因 .
(4)Cu晶体的堆积方式如图所示,设Cu原子半径为r,
晶体中Cu原子的配位数为_______,晶体的空间利用率
为 ( 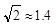 ,列式并计算结果)。
,列式并计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为________________。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______________(写化学式),非金属气态氢化物还原性最强的是_________________(写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有___________(写出其中两种物质的化学式)。
(4) X2M的燃烧热ΔH =-a kJ·mol-1,写出X2M燃烧反应的热化学方程式:___________________________。
(5)ZX的电子式为___________;ZX与水反应放出气体的化学方程式为____。
(6)熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为: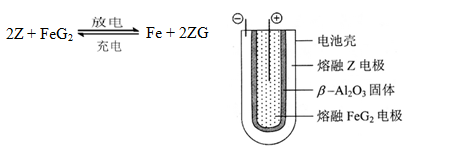
放电时,电池的正极反应式为_______________:
充电时,______________(写物质名称)电极接电源的负极;
该电池的电解质为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A~E五种元素中,除E外均为短周期元素,且原子序数依次增大。它们的原子
结构或性质如下表所示:
| 元素 | A | B | C | D | E |
| 结构或性质 | 原子半径最小的元素 | 地壳中含量最多的元素 | 可与B形成阴阳离子个数比为1:2的两种化合物 | 与B同主族 | 单质是生活中最常见的金属,可被磁铁吸引 |
 2H2O+O2↑和 。若在X极收集气体672 mL,在Y极收集气体168 mL(均已折算为标况下体积),则Y电极质量减少 g。
2H2O+O2↑和 。若在X极收集气体672 mL,在Y极收集气体168 mL(均已折算为标况下体积),则Y电极质量减少 g。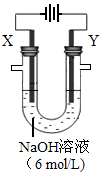
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表是元素周期表主族元素的一部分,短周期元素X的最高正化合价是+5,Y的单质
可在空气中燃烧。
| W | X | Y |
| | | Z |
| 编号 | 性质推测 | 化学方程式 |
| 示例 | 氧化性 | H2ZO3+4HI=Z↓+2I2+3H2O |
| 1 | | |
| 2 | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5,X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和,Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X元素形成氢化物和最高价氧化物的水化物能发生反应。请回答:
(1)X元素在周期表中的位置 ,X元素形成氢化物和最高价氧化物的水化物能发生反应的化学方程式 。
(2)Y的最高价氧化物的结构式是 。
(3)XZ3实验室制法的化学方程式为 。
(4)Z的简单氧化物属于 晶体。(填“分子”或“原子”)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F、G七种短周期主族元素的原子序数依次增大。A和E最外层电子数相同,短周期主族元素的原子中,E原子的半径最大;B、C和F在周期表中相邻,B、C同周期,C、F同主族,F原子的质子数是C原子质子数的2倍;A和C可形成两种常见的液态化合物X和Y(相对分子质量X<Y);D形成的分子为双原子分子。回答问题:
(1)D元素的名称为 ,F形成的离子的结构示意图为 。
(2)写出液态化合物Y的一种用途 。
(3)用某种金属易拉罐与A、C、E组成的化合物的水溶液反应,产生的气体可充填气球,请写出该反应的离子方程式 ,使用这种气球存在的隐患是 。
(4)P和Q两种物质都是由A、C、E、F四种元素组成的盐,其水溶液都显酸性,等物质的量的P和Q恰好完全反应。写出该反应的离子方程式: 。
(5)A、B、G三种元素两两组合形成的化合物在空气中相遇形成白烟,反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大,它们的最简氢化物分子的空间构型依次是正四面体形、三角锥形、正四面体形、角形(V形)、直线形。回答下列问题:
(1)Y的最高价氧化物的化学式为 。
(2)上述5种元素中,能形成酸性最强的含氧酸的元素是 ,写出该元素的任意3种含氧酸的化学式: 、 、 。
(3)D和Y形成的化合物分子的空间构型为 。
(4)D和X形成的化合物的化学键类型是 ,其晶体类型是 。
(5)试比较D和X的最高价氧化物熔点的高低并说明理由: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
按照下列元素基态原子的电子排布特征判断元素,并回答问题:A原子中只有一个电子层且只含有一个电子;B原子的3p轨道上得到一个电子后不能再容纳外来电子;C原子的2p轨道上有一个电子的自旋方向与2p轨道上其他电子的自旋方向相反;D原子的第三电子层上有8个电子,第四层上只有1个电子;E原子的价电子排布式为3s23p6。
(1)A~E分别是哪种元素(用元素符号填空):
A:__________;B:________;C:__________;D:________;E:________。
(2)E的原子结构示意图________________。
(3)C的轨道表示式____________________。
(4)B原子的核外电子排布式________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com