
A~E五种元素中,除E外均为短周期元素,且原子序数依次增大。它们的原子
结构或性质如下表所示:
| 元素 | A | B | C | D | E |
| 结构或性质 | 原子半径最小的元素 | 地壳中含量最多的元素 | 可与B形成阴阳离子个数比为1:2的两种化合物 | 与B同主族 | 单质是生活中最常见的金属,可被磁铁吸引 |
 2H2O+O2↑和 。若在X极收集气体672 mL,在Y极收集气体168 mL(均已折算为标况下体积),则Y电极质量减少 g。
2H2O+O2↑和 。若在X极收集气体672 mL,在Y极收集气体168 mL(均已折算为标况下体积),则Y电极质量减少 g。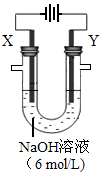
(1)第三周期第ⅥA
(2)离子键、非极性共价键
(3) ;Na2S、NaHS、Na2SO3
;Na2S、NaHS、Na2SO3
(4)Fe-6e-+8OH-= FeO42-+4H2O;0.28g;
(5)a O、S、Se同主族,气态氢化物的稳定性逐渐减弱,即与氢气化合的能力逐渐减弱,反应放出的热量逐渐减少,吸收能量逐渐增加
解析试题分析:(1)B地壳中含量最多的元素,B是O元素,则D是S元素,在元素周期表中位于第三周期第ⅥA
(2)C可与B形成阴阳离子个数比为1:2的两种化合物,且C的原子序数大于8,所以C是Na元素,形成的化合物是过氧化钠,含有的化学键类型为离子键、非极性共价键;
(3)A是H元素,甲能抑制水的电离,说明甲为碱,结合H、O、Na、S形成的强电解质,所以甲为氢氧化钠,其电子式为 ;乙能促进水的电离,说明乙是水解显碱性的盐,所以乙为硫化钠Na2S、硫氢化钠NaHS、亚硫酸钠Na2SO3,
;乙能促进水的电离,说明乙是水解显碱性的盐,所以乙为硫化钠Na2S、硫氢化钠NaHS、亚硫酸钠Na2SO3,
(4)E为铁,该装置制取高效净水剂Na2FeO4,所以Y极除生成氧气外还有Na2FeO4生成,电极反应方程式为Fe-6e-+8OH-= FeO42-+4H2O;X极产生氢气,得电子的物质的量为0.672L/22.4L/mol×2=0.06mol,Y极产生氧气,失电子的物质的量为0.168L/22.4L/mol×4=0.03mol,所以铁失电子的物质的量是0.06-0.03=0.03mol,则铁溶解的质量为0.03mol÷6×56g/mol=0.28g;
(5)O、S、Se同主族,气态氢化物的稳定性逐渐减弱,即与氢气化合的能力减弱,反应放出的热量逐渐减少,吸收能量逐渐增加,所以选a。
考点:考查元素推断,元素位置的判断,化学键类型的判断,电子式、电极反应方程式的书写,氧化还原反应的计算,热效应的判断


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:填空题
(12分,每空2分)氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用可产生NaOH和NH3。请回答下列问题:
(1)Na3N的电子式是_______;该化合物是由______键形成的_____(填“离子”或“共价”)化合物。
(2)Na3N与盐酸反应生成__________种盐,对应的反应方程式是 。
(3)比较Na3N中两种微粒的半径:r(Na+)__________r(N3-)(填“>”“=”“<”符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)写出氯原子的原子结构示意图
(2)氯元素的原子在反应中易 (填“得”或“失”) 个电子,表现出 性。
(3)氯元素的最高化合价为 ,最低化合价为 。
(4)氯元素的非金属性 (填“强”或“弱”)于硫元素的非金属性。
(5)写出氯元素、硫元素最高价氧化物对应水合物的化学式并比较酸性强弱 。
(6)请写出下列物质的电子式。NaCl H2O CO2 N2 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F均为短周期主族元素,且原子序数依次增大。短周期元素中C的原子半径最大,B、E同族,E的最外层电子数是电子层数的2倍,A的最高价氧化物水化物为H2AO3,D是地壳中含量最高的金属元素。
(1)A的元素符号是 ,C2B2的电子式为 。
(2)B、C、D、F的离子半径由大到小的顺序是 (用离子符号表示)。
(3)E和F相比,非金属性强的是 (用元素符号表示),下列事实能证明这一结论的是 (用符号填空)。
①常温下E的单质呈固态,F的单质呈气态 ②气态氢化物的稳定性:F>E ③E和F形成的化合物中,E显正价 ④F单质能与E的氢化物发生置换反应 ⑤E和F的氧化物的水化物的酸性强弱 ⑥气态氢化物的还原性:E>F
(4)把CDB2溶液蒸干所得的固体物质为 (填化学式)。
(5)C和F可组成化合物甲,用惰性电极电解甲的水溶液,电解的化学方程式为 。
(6)A、B、C三种元素组成的常见化合物乙的溶液中,离子浓度由大到小的顺序为 ,pH=10的乙溶液中由水电离产生的c(OH-)= mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在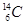 、
、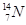 、
、 、
、 、
、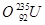 、
、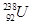 中;
中;
(1) 和 互为同位素
(2) 和 的质量数相等,但不能互称为同位素
(3) 和 的中子数相等,但质子数不相等,所以不是同一种元素.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
W、M、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代;M的氧化物是导致酸雨的主要物质之一。X的某一种单质是大气污染物监测物之一;Y的基态原子核外有6个原子轨道处于半充满状态;Z能形成红色的Z2O和黑色的ZO两种氧化物。
(1)Y3+基态的电子排布式可表示为 。
(2)MX3-的空间构型 (用文字描述)。
(3)M可形成多种氢化物,其中MH3的碱性强于M2H4的原因是 。
(4)根据等电子原理,WX分子的结构式为 。
(5)1 mol WX2中含有的σ键数目为 。
(6)H2X分子中X原子轨道的杂化类型为 。
(7)向Z2+的溶液中加入过量NaOH溶液,可生成Z的配位数为4的配位离子,写出该配位离子的结构式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格:
(1)在这10种元素中,非金属性最强的是 (填序号);
(2)元素②⑧⑨以原子个数比1:1:1形成的化合物的结构式为 ,元素②与⑨形成的18e-化合物的电子式 ;
(3)②⑨⑩三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M中含有的化学键类型有 ;
(4)比较元素⑦⑧形成的气态氢化物的稳定性: > (用化学式表示)
(5)元素⑤的氧化物与氢氧化钠溶液反应的离子方程式 。
(6)元素④和③形成的化合物属于 化合物,用电子式表示其形成过程 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有A、B、C、D四种元素,A和B两种元素的原子各有两个电子层;C、D两元素的原子各有三个电子层。A和B能化合生成无色无味的气体AB2,C和D能化合生成C2D,B和D是同族元素,B离子和C离子核外电子数相同。
(1)这四种元素分别是:A ,B ,C ,D 。
(2)用电子式表示C和D形成化合物的过程: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
光伏并网发电并使用半导体(LED)照明可以节约大量能源。已知发出白光的LED是由氮化镓(GaN)芯片和钇铝石榴石(YAG,化学式:Y3Al5O12)芯片封装在一起做成的,如图所示。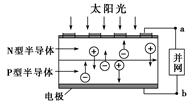
(1)砷与氮位于同主族,砷化镓也是半导体材料,它的化学式为________。
(2)用简单氧化物形式表示YAG的组成:________。
(3)下列有关光伏并网发电的叙述正确的是________(填序号)。
①LED是新型无机高分子材料
②电流从a流向b
③光伏电池是将太阳能直接转化为电能
④图中N型半导体为正极,P型半导体为负极
⑤如果工业上用光伏电池并网发电精炼粗铜,a极连接精铜电极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com