
光伏并网发电并使用半导体(LED)照明可以节约大量能源。已知发出白光的LED是由氮化镓(GaN)芯片和钇铝石榴石(YAG,化学式:Y3Al5O12)芯片封装在一起做成的,如图所示。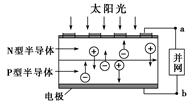
(1)砷与氮位于同主族,砷化镓也是半导体材料,它的化学式为________。
(2)用简单氧化物形式表示YAG的组成:________。
(3)下列有关光伏并网发电的叙述正确的是________(填序号)。
①LED是新型无机高分子材料
②电流从a流向b
③光伏电池是将太阳能直接转化为电能
④图中N型半导体为正极,P型半导体为负极
⑤如果工业上用光伏电池并网发电精炼粗铜,a极连接精铜电极
科目:高中化学 来源: 题型:填空题
A~E五种元素中,除E外均为短周期元素,且原子序数依次增大。它们的原子
结构或性质如下表所示:
| 元素 | A | B | C | D | E |
| 结构或性质 | 原子半径最小的元素 | 地壳中含量最多的元素 | 可与B形成阴阳离子个数比为1:2的两种化合物 | 与B同主族 | 单质是生活中最常见的金属,可被磁铁吸引 |
 2H2O+O2↑和 。若在X极收集气体672 mL,在Y极收集气体168 mL(均已折算为标况下体积),则Y电极质量减少 g。
2H2O+O2↑和 。若在X极收集气体672 mL,在Y极收集气体168 mL(均已折算为标况下体积),则Y电极质量减少 g。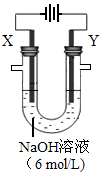
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大,它们的最简氢化物分子的空间构型依次是正四面体形、三角锥形、正四面体形、角形(V形)、直线形。回答下列问题:
(1)Y的最高价氧化物的化学式为 。
(2)上述5种元素中,能形成酸性最强的含氧酸的元素是 ,写出该元素的任意3种含氧酸的化学式: 、 、 。
(3)D和Y形成的化合物分子的空间构型为 。
(4)D和X形成的化合物的化学键类型是 ,其晶体类型是 。
(5)试比较D和X的最高价氧化物熔点的高低并说明理由: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F六种短周期元素的原子序数依次增大。A、D同族,B、C同周期;B原子最外层电子数是次外层的两倍;在周期表中A的原子半径最小;C是地壳中含量最多的元素,C是F不同周期的邻族元素;E和F的原子序数之和为30。由上述六种元素中的几种元素组成的甲、乙、丙、丁、戊、己六种化合物如下表所示:
元素形成的化合物
| 化合物 | 甲 | 乙 | 丙 |
| 各元素原子 个数比 | N(A):N(C) =2:1 | N(A):N(C) =1:1 | N(B):N(A) =1:4 |
| 化合物 | 丁 | 戊 | 己 |
| 各元素原子 个数比 | N(D):N(B):N(C) =2:1:3 | N(E):N(F) =1:3 | N(B):N(F) =1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍。X、Y和Z分属不同的周期,它们的原子序数之和是W原子序数的5倍。在由元素W、X、Y、Z组成的所有可能的二组分化合物中,由元素W与Y形成的化合物M的熔点最高。请回答下列问题:
(1)W元素原子的L层轨道表示式为________,W3分子的空间构型为________;
(2)化合物M的晶体结构与NaCl相同,而熔点高于NaCl。M熔点较高的原因是____________________。将一定量的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中,碳原子采用的杂化方式有________,O—C—O的键角约为________;
(3)X、Y、Z可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角,Z处于体心位置,则该晶体的组成为X∶Y∶Z=________;
(4)含有元素Z的盐的焰色反应为紫色。许多金属盐都可以发生焰色反应,其原因是__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物。
(1)①H、C、N、0四种元素的电负性由小到大的顺序为_____________________。
②下列叙述不正确的是_____________。(填字母)
A.因为HCHO与水分子间能形成氢键,所以HCHO易溶于水
B.HCHO和CO2分子中的中心原子均采用 杂化
杂化
C.C6H6分子中含有6个 键和1个大
键和1个大 键,C2H2是非极性分子
键,C2H2是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是__________。
②六氰合亚铁离子[Fe(CN)6] 中不存在______________________________________。
中不存在______________________________________。
A.共价键 B.非极性键 C.配位键 D. 键 E.
键 E. 键
键
写出一种与CN-互为等电子体粒子的分子式_____________________。
(3) SO3分子的立体构型为_____________,SeO32-的立体构型为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
按照下列元素基态原子的电子排布特征判断元素,并回答问题:A原子中只有一个电子层且只含有一个电子;B原子的3p轨道上得到一个电子后不能再容纳外来电子;C原子的2p轨道上有一个电子的自旋方向与2p轨道上其他电子的自旋方向相反;D原子的第三电子层上有8个电子,第四层上只有1个电子;E原子的价电子排布式为3s23p6。
(1)A~E分别是哪种元素(用元素符号填空):
A:__________;B:________;C:__________;D:________;E:________。
(2)E的原子结构示意图________________。
(3)C的轨道表示式____________________。
(4)B原子的核外电子排布式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
制冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到制冷的目的。人们曾采用乙醚、NH3、CH3Cl等作制冷制,但它们不是有毒就是易燃,于是科学家根据元素性质的递变规律来开发新的制冷剂。根据已有知识,某些元素化合物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:
SiH4>PH3>H2S>HCl,则________>________>H2O>HF(填物质的化学式)。
(2)化合物的毒性:
PH3>NH3,CCl4>CF4,则H2S________H2O,CS2________CO2(填“>”“=”或“<”)。
于是科学家们开始把注意力集中在含F、Cl的化合物上。
(3)已知CCl4的沸点为76.8 ℃,CF4的沸点为-128 ℃,新的制冷剂的沸点范围应介于二者之间,经过较长时间的反复实验,发现了制冷剂CF2Cl2(氟利昂),其他类似的制冷剂可以是________。
(4)然而这种制冷剂造成的当今某一环境问题是_____________________________。
但求助于周期表中元素及其化合物的______(填写下列选项的编号)变化趋势开发制冷剂的科学思维方法是值得借鉴的。
①毒性;②沸点;③易燃性;④水溶性;⑤颜色
| A.①②③ | B.②④⑤ | C.②③④ | D.①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089 nm)。
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com