
A、B、C、D、E、F六种短周期元素的原子序数依次增大。A、D同族,B、C同周期;B原子最外层电子数是次外层的两倍;在周期表中A的原子半径最小;C是地壳中含量最多的元素,C是F不同周期的邻族元素;E和F的原子序数之和为30。由上述六种元素中的几种元素组成的甲、乙、丙、丁、戊、己六种化合物如下表所示:
元素形成的化合物
| 化合物 | 甲 | 乙 | 丙 |
| 各元素原子 个数比 | N(A):N(C) =2:1 | N(A):N(C) =1:1 | N(B):N(A) =1:4 |
| 化合物 | 丁 | 戊 | 己 |
| 各元素原子 个数比 | N(D):N(B):N(C) =2:1:3 | N(E):N(F) =1:3 | N(B):N(F) =1:4 |
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F均为短周期主族元素,且原子序数依次增大。短周期元素中C的原子半径最大,B、E同族,E的最外层电子数是电子层数的2倍,A的最高价氧化物水化物为H2AO3,D是地壳中含量最高的金属元素。
(1)A的元素符号是 ,C2B2的电子式为 。
(2)B、C、D、F的离子半径由大到小的顺序是 (用离子符号表示)。
(3)E和F相比,非金属性强的是 (用元素符号表示),下列事实能证明这一结论的是 (用符号填空)。
①常温下E的单质呈固态,F的单质呈气态 ②气态氢化物的稳定性:F>E ③E和F形成的化合物中,E显正价 ④F单质能与E的氢化物发生置换反应 ⑤E和F的氧化物的水化物的酸性强弱 ⑥气态氢化物的还原性:E>F
(4)把CDB2溶液蒸干所得的固体物质为 (填化学式)。
(5)C和F可组成化合物甲,用惰性电极电解甲的水溶液,电解的化学方程式为 。
(6)A、B、C三种元素组成的常见化合物乙的溶液中,离子浓度由大到小的顺序为 ,pH=10的乙溶液中由水电离产生的c(OH-)= mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有A、B、C、D四种元素,A和B两种元素的原子各有两个电子层;C、D两元素的原子各有三个电子层。A和B能化合生成无色无味的气体AB2,C和D能化合生成C2D,B和D是同族元素,B离子和C离子核外电子数相同。
(1)这四种元素分别是:A ,B ,C ,D 。
(2)用电子式表示C和D形成化合物的过程: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
I.下面的虚线框中每一列、每一行相当于周期表的每一族和每一周期,但它的列数和行数都多于元素周期表。请在下面的虚线框中用实线画出周期表第1至第6周期的轮廓,并画出金属与非金属的分界线。
| | | | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图是 。
(2)已知某粒子的结构示意图为: ,试回答:
,试回答:
①当x-y=10时,该粒子为 (填“原子”“阳离子”或“阴离子”)。
②当y=8时,粒子可能为(填名称) 、 、 、 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价:
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
光伏并网发电并使用半导体(LED)照明可以节约大量能源。已知发出白光的LED是由氮化镓(GaN)芯片和钇铝石榴石(YAG,化学式:Y3Al5O12)芯片封装在一起做成的,如图所示。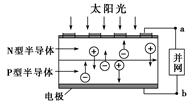
(1)砷与氮位于同主族,砷化镓也是半导体材料,它的化学式为________。
(2)用简单氧化物形式表示YAG的组成:________。
(3)下列有关光伏并网发电的叙述正确的是________(填序号)。
①LED是新型无机高分子材料
②电流从a流向b
③光伏电池是将太阳能直接转化为电能
④图中N型半导体为正极,P型半导体为负极
⑤如果工业上用光伏电池并网发电精炼粗铜,a极连接精铜电极
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
| 元素 | A | B | C | D |
| 性质结构信息 | 原子中最外层电子数为电子层数的2倍。常温下为淡黄色固体,其燃烧热为Q KJ/mol | 单质常温、常压下是气体,能溶于水。原子的M层p轨道有1个未成对的电子 | 单质质软、银白色固体、导电性强。单质在空气中燃烧发出黄色的火焰。 | 原子最外层电子层上s电子数等于p电子数。单质是一种重要的半导体材料。 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D 4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C。
(1)B元素的名称为__________;B在周期表中的位置是第________周期第________族。
(2)A、B形成的化合物的电子式为________。
(3)C的元素符号为________,C的最高价氧化物的化学式为____________。
(4)D的最高价氧化物对应的水化物的化学式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com