
A、B、C、D、E、F均为短周期主族元素,且原子序数依次增大。短周期元素中C的原子半径最大,B、E同族,E的最外层电子数是电子层数的2倍,A的最高价氧化物水化物为H2AO3,D是地壳中含量最高的金属元素。
(1)A的元素符号是 ,C2B2的电子式为 。
(2)B、C、D、F的离子半径由大到小的顺序是 (用离子符号表示)。
(3)E和F相比,非金属性强的是 (用元素符号表示),下列事实能证明这一结论的是 (用符号填空)。
①常温下E的单质呈固态,F的单质呈气态 ②气态氢化物的稳定性:F>E ③E和F形成的化合物中,E显正价 ④F单质能与E的氢化物发生置换反应 ⑤E和F的氧化物的水化物的酸性强弱 ⑥气态氢化物的还原性:E>F
(4)把CDB2溶液蒸干所得的固体物质为 (填化学式)。
(5)C和F可组成化合物甲,用惰性电极电解甲的水溶液,电解的化学方程式为 。
(6)A、B、C三种元素组成的常见化合物乙的溶液中,离子浓度由大到小的顺序为 ,pH=10的乙溶液中由水电离产生的c(OH-)= mol·L-1。
科目:高中化学 来源: 题型:填空题
(15分)X、Y、Z、W、R、T为前四周期元素且原子序数依次增大。T原子序数等于X、Y、R原子序数之和。Z为地壳中含量最多的元素。X、Z原子核外均有2个未成对电子。Z与R位于同一主族。X、Y、Z、W、R、T中只有两种金属元素,且存在下列反应: 2W+XZ2 X+2WZ
X+2WZ
回答下列问题:
(1)X、Y、Z的第一电离能最大的是 (用元素符号表示)。
(2)在元素R和元素Z形成的常见化合物中,属于非极性分子的是 (填化学式),该分子中中心原子以 杂化。
(3)由X、T元素组成的单质中一定不存在 (填序号)。
| A.离子晶体 | B.分子晶体 | C.原子晶体 | D.金属晶体 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
己知X、Y、Z、W、N、U、V是短周期的主族元素,原子序数依次增大。X与N同主族,且与W都能形成A2B、A2B2型化合物;Z、W的单质常温下均为无色气体;Y原子的L层电子数是K层电子数的2倍;U原子的最外层电子数是其电子层数的2倍,试回答下列问题:
(1)YW2的电子式 ;Z的氢化物结构式为 ;写出U元素在周期表中的位置 。
(2)原子半径:U V(填>、<或=,下同);气态氢化物的水溶液的酸性:U V。
(3)写出UW2与V元素的单质在水溶液中反应的化学方程式是 。
(4)由X、Z组成的一种化合物化学式为ZX5,其各原子均达到同周期稀有气体原子的稳定结构,该物质属于 (填“离子”或“共价”)化合物。
(5)X、Y、Z、W四种元素(按顺序)可组成原子个数比为5:1:1:3的化合物,该化合物的稀溶液与足量氢氧化钠溶液在加热条件下反应的离子方程式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
元素的性质在元素周期表中按其排列呈现一定的规律。下表为元素周期表中部分元素,根据要求回答下列问题:
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
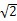 ”的式子表示,不必算结果)
”的式子表示,不必算结果)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为________________。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______________(写化学式),非金属气态氢化物还原性最强的是_________________(写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有___________(写出其中两种物质的化学式)。
(4) X2M的燃烧热ΔH =-a kJ·mol-1,写出X2M燃烧反应的热化学方程式:___________________________。
(5)ZX的电子式为___________;ZX与水反应放出气体的化学方程式为____。
(6)熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为: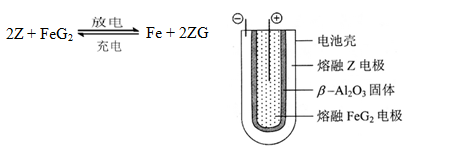
放电时,电池的正极反应式为_______________:
充电时,______________(写物质名称)电极接电源的负极;
该电池的电解质为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表是元素周期表的一部分,回答下列有关问题: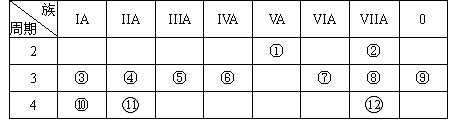
(1)写出下列元素符号:① ,⑥ ,⑦ 。
(2)画出原子的结构示意图:④ ,⑤ ,⑧ 。
(3)在这些元素中,最活泼的金属元素是 ,最活泼的非金属元素是 ,最不活泼的元素是 。(均填元素符号)
(4)在这些元素的最高价氧化物对应水化物中,酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 。
(5)在③与④中,化学性质较活泼的是 (填元素符号),怎样用化学实验证明:
答: (该空2分,其余每空1分)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A~E五种元素中,除E外均为短周期元素,且原子序数依次增大。它们的原子
结构或性质如下表所示:
| 元素 | A | B | C | D | E |
| 结构或性质 | 原子半径最小的元素 | 地壳中含量最多的元素 | 可与B形成阴阳离子个数比为1:2的两种化合物 | 与B同主族 | 单质是生活中最常见的金属,可被磁铁吸引 |
 2H2O+O2↑和 。若在X极收集气体672 mL,在Y极收集气体168 mL(均已折算为标况下体积),则Y电极质量减少 g。
2H2O+O2↑和 。若在X极收集气体672 mL,在Y极收集气体168 mL(均已折算为标况下体积),则Y电极质量减少 g。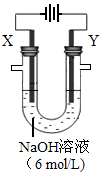
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5,X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和,Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X元素形成氢化物和最高价氧化物的水化物能发生反应。请回答:
(1)X元素在周期表中的位置 ,X元素形成氢化物和最高价氧化物的水化物能发生反应的化学方程式 。
(2)Y的最高价氧化物的结构式是 。
(3)XZ3实验室制法的化学方程式为 。
(4)Z的简单氧化物属于 晶体。(填“分子”或“原子”)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F六种短周期元素的原子序数依次增大。A、D同族,B、C同周期;B原子最外层电子数是次外层的两倍;在周期表中A的原子半径最小;C是地壳中含量最多的元素,C是F不同周期的邻族元素;E和F的原子序数之和为30。由上述六种元素中的几种元素组成的甲、乙、丙、丁、戊、己六种化合物如下表所示:
元素形成的化合物
| 化合物 | 甲 | 乙 | 丙 |
| 各元素原子 个数比 | N(A):N(C) =2:1 | N(A):N(C) =1:1 | N(B):N(A) =1:4 |
| 化合物 | 丁 | 戊 | 己 |
| 各元素原子 个数比 | N(D):N(B):N(C) =2:1:3 | N(E):N(F) =1:3 | N(B):N(F) =1:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com