


科目:高中化学 来源: 题型:
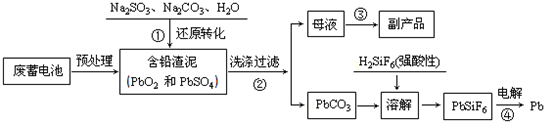
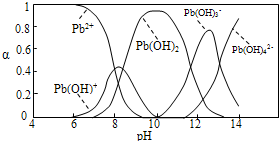
| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度/(mg?L-1) | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度/(mg?L-1) | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
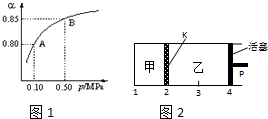 硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一.
硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一.查看答案和解析>>
科目:高中化学 来源: 题型:
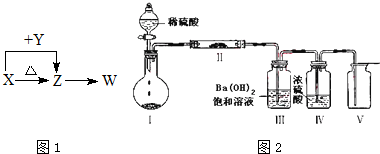
查看答案和解析>>
科目:高中化学 来源: 题型:
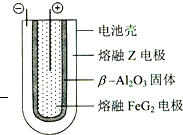 X、Y、Z、M、Q、G六种短周期元素,原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,Y的一种同位素原子常用于测定文物的年代;Q形成的单质为淡黄色固体.请回答下列问题(涉及物质均用化学式表示).
X、Y、Z、M、Q、G六种短周期元素,原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,Y的一种同位素原子常用于测定文物的年代;Q形成的单质为淡黄色固体.请回答下列问题(涉及物质均用化学式表示).| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第七周期共有50种元素 |
| B、第七周期最后一种元素不与任何物质发生反应 |
| C、第七周期ⅦA族元素的原子在化学反应中可以得到1个电子 |
| D、第七周期任何一种元素的原子最外层上不超过8个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com