
| 碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 阳离子半径/pm | 66 | 99 | 112 | 135 |
| A、离子晶体中阳离子的半径越大,越易分解 |
| B、离子晶体中阳离子的半径越小,越易分解 |
| C、离子晶体中阳离子的半径越大,结合碳酸根中的氧离子越容易 |
| D、离子晶体中阳离子的半径越小,结合碳酸根中的氧离子越容易 |
科目:高中化学 来源: 题型:
c(HS
| ||
c(S
|
| c(H2SO3) |
| c(HSO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5条 | B、6条 | C、7条 | D、8条 |
查看答案和解析>>
科目:高中化学 来源: 题型:
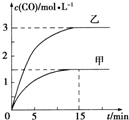 T℃下发生反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、乙两个恒容密闭容器中加入一定量C和H2O,各容器的容积、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示:下列说法正确的是( )
T℃下发生反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、乙两个恒容密闭容器中加入一定量C和H2O,各容器的容积、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示:下列说法正确的是( )| 容器 | 甲 | 乙 |
| 容积 | 0.5L | V |
| 2molC 1molH2O | 4molC 2molH2O |
| A、甲容器中前15min反应的平均速率υ(H2)=0.2 mol?L-1?min-1 |
| B、乙容器的容积V=0.5 L |
| C、向甲容器加入少量C(s),平衡正向移动 |
| D、反应温度升高,平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X单质不易与水反应 |
| B、XO2可被碳还原为X |
| C、XH4的稳定性比SiH4的高 |
| D、X的半径比Si的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HF>HCl>HBr>HI |
| B、HCl>HBr>HI>HF |
| C、HBr>HI>HF>HCl |
| D、HI>HBr>HCl>HF |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、糖类、油脂、蛋白质属于天然高分子化合物 |
| B、维生素C具有还原性,在人体内起抗氧化作用 |
| C、煤经气化和液化两个物理变化过程,可变为清洁能源 |
| D、制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、①<②<③<④ |
| B、②<①<③<④ |
| C、②<①<④<③ |
| D、①<②<④<③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com