我国国家标准(GB2760-2011)规定葡萄酒中SO
2最大使用量为0.25g?L
-1.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO
2,并对其含量进行测定.
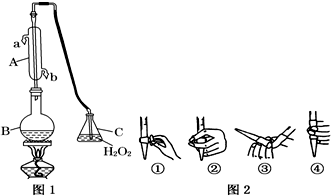
(1)仪器A的名称是
,水通入A的进口为
.
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO
2全部逸出并与C中H
2O
2完全反应,其化学方程式为
(3)除去C中过量的H
2O
2,然后用0.090 0mol?L
-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的
;若滴定终点时溶液的pH=8.8,则选择的指示剂为
;若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)
(①=10mL,②=40mL,③<10mL,④>40mL)
(4)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO
2含量为:
g?L
-1.
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:
.
(6)常温下,用一定量的NaOH溶液吸收逸出的SO
2气体,吸收后的吸收液恰好呈中性,下列关于吸收液的说法正确的是
A.c(Na
+)=c(HSO
3-)+2c(SO
32-)
B.c(Na
+)>c(HSO
3-)=c(SO
32-)>c(H
+)=c(OH
-)
C.2c(Na
+)=3c(H
2SO
3)+3c(HSO
3-)+3c(SO
32-)
D.c(Na
+)>c(HSO
3-)+c(SO
32-)+c(H
2SO
3)
E.
>
.




 某烃A 0.2mol在氧气中充分燃烧后,生成化合物B、C各1.2mol,试回答下列问题:
某烃A 0.2mol在氧气中充分燃烧后,生成化合物B、C各1.2mol,试回答下列问题: