
����Ŀ����֪Ba(AlO2)2������ˮ����ͼ��ʾ������Al2(SO4)3��Һ����μ���Ba(OH)2��Һʱ�����ɳ��������ʵ���y�����Ba(OH)2�����ʵ���x�Ĺ�ϵ�������й�������ȷ����

A. a��bʱ���������ʵ�����Al(OH)3��BaSO4��
B. d��eʱ��Һ�����ӵ����ʵ�����Ba2�����ܵ���OH��
C. a��dʱ���������ʵ�����BaSO4����С��Al(OH)3
D. c��dʱ��Һ�����ӵ����ʵ�����AlO2����Ba2����
���𰸡�B
��������A����b��ʱ������ӦAl2(SO4)3+3Ba(OH)2=2Al(OH)3��+3BaSO4�����������ʵ�����Al(OH)3��BaSO4����A����B��d-e���У�ij��ʱ�������Ba(OH)2�����ʵ�������Ba(AlO2)2�����ʵ���ʱ����Һ��Ba2����OH��������ȣ���B��ȷ��C������1molAl2(SO4)3����Һ�к���2molAl3����3molSO42��������Һ����μ���Ba(OH)2��Һʱ�����ķ�ӦΪ��Al3��+3OH��=Al(OH)3����SO42��+Ba2��=BaSO4������2molAl3����ȫ����ʱ������3molBa(OH)2����ʱ3molSO42��ȫ�����������ɳ���Ϊ2molAl(OH)3��3molBaSO4��5mol����ˣ���������Ӧ������BaSO4�����ʵ���ʼ�մ���Al(OH)3�����ʵ�������C����D��c-d������Ӧ2Al(OH)3+Ba(OH)2=Ba(AlO2)2+4H2O��1molBa(AlO2)2�����2molAlO2����1molBa2������AlO2����Ba2���࣬��D����ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����л����У�ֻ�������ˮ����һһ������ǣ� ��
A.��ϩ���������Ȼ�̼
B.������Ȳ����ϩ
C.���顢����������
D.�ױ������顢��ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��8.34g FeSO47H2O��Ʒ�ڸ�������������������ˮ���̵��������ߣ���Ʒ�������¶ȱ仯�����ߣ���ͼ��ʾ������˵������ȷ���ǣ� �� 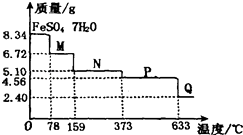
A.�¶�Ϊ78��ʱ��������M�Ļ�ѧʽΪFeSO4?5H2O
B.�¶�Ϊl59��ʱ��������N�Ļ�ѧʽΪFeSO4?3H2O
C.�ڸ���������������N�õ�P�Ļ�ѧ����ʽΪFeSO4 ![]() ?FeO+SO3��
?FeO+SO3��
D.ȡ����380��ʱ���õ���ƷP����������������650�棬�õ�һ�ֹ�������Q��ͬʱ��������ɫ�������ɣ�Q�Ļ�ѧʽΪFe2O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β���У�����NO�ķ�ӦΪ��N2��g��+O2��g��2NO��g����һ�������£������ʵ�����N2��g����O2��g���ں����ܱ������з�Ӧ����ͼ����a��ʾ�÷�Ӧ���¶�T��N2��Ũ����ʱ��ı仯������b��ʾ�÷�Ӧ��ijһ��ʼ�����ı�ʱN2��Ũ����ʱ��ı仯������������ȷ���ǣ� �� 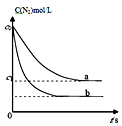
A.������b��Ӧ�������ı����¶ȣ����жϸ÷�Ӧ�ġ�H��0
B.�¶�T�£����ŷ�Ӧ�Ľ��У����������ܶȼ�С
C.����b��Ӧ�������ı�����Ǽ����˴���
D.�¶�T�£��÷�Ӧ��ƽ�ⳣ��K= ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50mL NaOH��Һ����ͨ��һ������CO2��������Һ������䣩�����ȡ����Һ10mL������ϡ����100mL�������ϡ�ͺ����Һ����μ���0.1molL��1�����ᣬ����CO2������������״���£��������������������ϵ��ͼ��ʾ�� 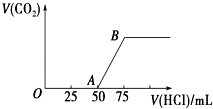
��1��д��OA����������Ӧ�����ӷ���ʽ�� ��
��2��NaOH������CO2��������Һ������Ϊ �� �����ʵ���Ũ��֮��Ϊ ��
��3��������CO2�������״���£�Ϊ ��
��4��ԭNaOH��Һ�����ʵ���Ũ��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������Ҫ��������������������й㷺Ӧ�ã����������ж����������γ��������Ҫ���壮������ʵ�����Ʊ����ǹ�ҵ��������������β�����ջ��������dz���Ҫ�����������գ�
��1��ʵ���ҿ���ͭ��Ũ������Ȼ�������������Ʒ�Ӧ��ȡ�������� 
�����������������Ʒ�Ӧ��ȡ��������ϣ���ܿ��Ʒ�Ӧ�ٶȣ���ͼ�п�ѡ�õķ���װ��������д��ĸ����
��2������������������Ʒ�Ӧ��ȡ3.36L����״������������������Ҫ��ȡ��������g������һλС�������������40%�������ƣ��������������������������ƣ����������ȡ����������g ������һλС������
��3��ʵ���Ҷ�������β�������빤ҵ��������Ļ�ѧԭ����ͨ��ʯ�ҩ�ʯ�෨�ͼ�dz��õ���������
ʯ�ҩ�ʯ�෨�����շ�ӦΪSO2+Ca��OH��2��CaSO3��+H2O�����ղ�����������ɹܵ���������������������ӦΪ2CaSO3+O2+4H2O��2CaSO42H2O����������ͼ1��������շ�ӦΪSO2+2NaOH��Na2SO3+H2O������ص����������Ƽ���ǿ�����տ졢Ч�ʸߣ���������ͼ2��
��֪��
�Լ� | Ca��OH��2 | NaOH |
�۸�Ԫ/kg�� | 0.36 | 2.9 |
����SO2�ijɱ���Ԫ/mol�� | 0.027 | 0.232 |
ʯ�ҩ�ʯ�෨�ͼ���ն�������Ļ�ѧԭ����֮ͬ���� �� �ͼ��ȣ�ʯ�ҩ�ʯ�෨���ŵ��� �� ȱ���� ��
��4����ʯ�ҩ�ʯ�෨�ͼ�Ļ����ϣ����һ���Ľ��ġ���ʵ������ѭ��������������������ͼ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ������ԭ������۽��͵����� ��
A����Ƭ�������ⷽ������
B�������ȴ���������
C��������ʱ�ô�п�����ô�п
D������ʩ����������ˮ����ˢһ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��KClO3��Ũ������һ���¶��·�Ӧ�����ɻ���ɫ���ױ���������ȣ��仯ѧ����ʽΪ��2KClO3��4HCl(Ũ)��2KCl��2ClO2����Cl2����2H2O����ClO2����Ԫ�صĻ��ϼ�Ϊ��4�ۣ�
��1��Ũ�����ڷ�Ӧ�б��ֳ�����������_______����д��ţ�
��ֻ�л�ԭ�� �ڻ�ԭ�Ժ����� ��ֻ�������� �������Ժ�����
��2������0.1molCl2����ת�Ƶ��ӵ����ʵ���Ϊ________mol��
��3����˫���ű�ʾ�����Ӧ���ӵ�ת�����2KClO3��4HCl(Ũ)��2KCl��2ClO2����Cl2����2H2O��
_____________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����³�ѹ�£������л�����Һ̬��ʽ���ڵ���
A. ����B. ��ϩC. һ�ȼ���D. ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com